基因工程又可称为重组DNA技术、分子克隆技术、基因的无性繁殖、基因操作、基因克隆技术。(三)基因工程载体能够将外源DNA载入宿主细胞进行复制、整合或表达的工具称为载体。基因工程载体按照其用途大致可分为克隆载体和表达载体。目前克隆载体主要有质粒、噬菌体、柯斯质粒及人工染色体等。......
2023-06-24
一、酶工程概况
酶工程是酶学和工程学相互渗透、发展而形成的一门新的技术科学。它是从应用的目的出发研究酶、应用酶的特异催化功能,并通过工程化将相应原料转化成有用物质的技术。它的主要内容包括酶的发酵生产、酶的分离纯化、酶分子修饰、酶和细胞固定化等。
(一)酶的定义与特性
酶是一种由活细胞产生的生物催化剂。它存在于活细胞中,控制各种代谢过程,将营养物质转化成能量和细胞构成材料。在生物体外,只要条件适宜,某些酶也可催化相应的生化反应。酶除了具有一般催化剂的特性,如加快反应速率、降低反应活化能、不改变反应平衡点、反应前后无数量和性质变化等外,还具有独自的特点:催化效率高、专一性强、存在多种调节方式。
(二)酶的结构
绝大部分酶的化学本质是蛋白质(现已发现少数核酸也具有催化活性,称为核酶),因此酶具有一般蛋白质的基本性质,具有一、二、三、四级结构。根据酶的组成部分不同,可将其分为简单蛋白质和结合蛋白质。前一类分子中除蛋白质外不含其他成分,如胃蛋白酶、核糖核酸酶、淀粉酶等;后一类分子中除蛋白质(称为酶蛋白)外,还含有其他一些对热稳定的非蛋白质小分子物质(称为辅助因子),酶蛋白与辅助因子结合后形成的复合物称为全酶,只有全酶才具有酶活力。全酶中酶蛋白决定酶的专一性和高效率,而辅助因子则负责对电子、原子或某些化学基团起传递作用。辅助因子一般为有机化合物或金属离子。
(三)酶的活力测定
酶活力就是酶催化一定化学反应的能力。酶活力是指在一定条件下酶所催化的反应初速率。在外界条件相同的情况下,酶催化的反应速率越大,意味着酶活力越高。测定酶的活力,就是测定酶促反应的速率,并且是初速率。酶促反应速率通常用单位时间内、单位体积中底物的减少量或产物的增加量表示。
酶活力的大小是以酶活力的单位数来表示的。1961年国际酶学委员会规定:在特定条件下,1 min生成1μmol产物的酶量(或转化1μmol底物的酶量)为一个国际酶活力单位(IU)。1972年,国际酶学委员会又推荐了一个新的酶活力国际单位katal(kat),1 kat定义为:在最适条件下,每秒能使1 mol底物转化的酶量,1 kat=1 mol/s=6×107 IU。酶的比活力(或称比活性)是指每毫克酶蛋白所含的酶活力单位数。它是表示酶制剂纯度的一个指标,比活力越高,表明酶纯度越高。
酶的比活力=酶活力单位数/毫克(酶蛋白)
二、酶的来源及生产
(一)酶的来源
迄今在生物界已发现的酶有2000多种,工业应用者近百种。其来源主要以动植物材料及微生物细胞为原料,用现代生物化学技术分离纯化,或从微生物发酵液中分离。化学合成方法目前还不成熟。早期是以动植物为原料进行提取,由于动植物生长周期长,来源有限,受地理、气候和季节等因素的影响,不适于大规模生产,利用微生物来生产酶制品是一个更好的选择,其优点如下:微生物种类繁多,动植物体内的酶在微生物中几乎都可以找到;繁殖快、生产周期短、培养简便,并可以通过控制培养条件来提高产量;微生物具有较强的适应性,通过各种遗传变异手段能培育出新的高产菌株。
(二)酶的生产菌
(1)对菌种的要求 对菌种的要求如下:产酶量高,酶的性能符合使用要求,最好是胞外酶;不是致病菌,不产生毒素;稳定,不易变异退化,不易感染噬菌体;能利用廉价原料,发酵周期短,易于培养。
(2)生产菌来源 生产菌来源包括从菌种保藏机构、有关研究部门获取;从自然界中分离筛选,土壤、深海、温泉、火山、森林都是菌种采集地;生产菌的改良,基因突变、基因转移、基因克隆。
(3)常用产酶微生物 常用产酶微生物包括大肠杆菌、枯草杆菌、青霉菌、黑曲霉、米曲霉、木霉、根霉、链霉菌、啤酒酵母等。
(三)微生物酶的发酵生产
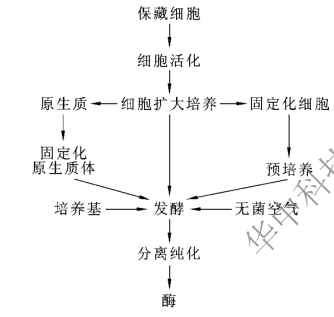
图1-1-10 酶发酵生产工艺流程
微生物酶的发酵生产是指在人工控制的条件下,有目的地利用微生物培养来生产所需的酶。它包括培养基配制、细胞活化与扩大培养、发酵方式的选择及发酵工艺条件的控制管理等方面的内容,如图1-1-10所示。
三、酶的分离纯化
(一)酶的分离纯化基本过程
酶的分离纯化是指把酶从组织、细胞内或细胞外液中提取出来,再与杂质分开,从而获得与使用目的相适应的酶制品的技术过程。其流程一般包括破碎细胞、溶剂抽提、离心、过滤、浓缩、干燥这几个步骤,对某些纯度要求很高的酶则需经几种方法乃至多次反复处理,如图1-1-11所示。
(二)酶分离纯化过程中的注意事项
在酶的提纯过程中,为了提高提取率,并防止酶变性失活,必须注意以下几点。
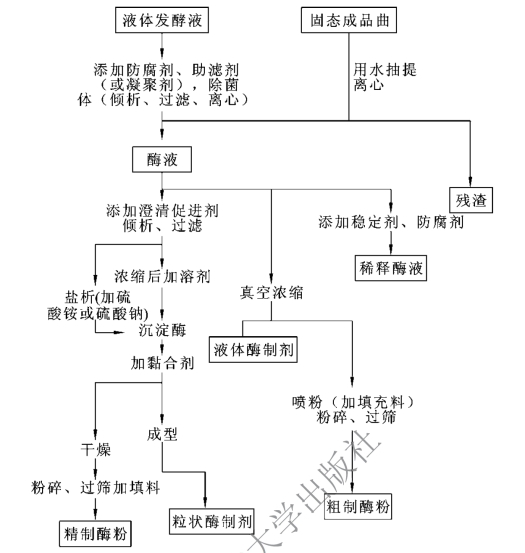
图1-1-11 酶制剂提取工艺流程
(1)温度 除少数耐热和低温敏感酶外,一般酶在0℃附近是较稳定的。
(2)pH 大多数酶在中性附近(pH6~8)稳定。当溶液的pH大于9或小于5时,酶往往会失活,要防止在调整溶液pH时添加酸、碱引起的局部过酸过碱。
(3)酶浓度 酶在低浓度下易失活,因此在操作中应注意酶浓度不宜太低。制备成固体(如干粉)更有利于保存。
(4)搅拌 剧烈的搅拌和酶溶液表面形成的薄膜容易引起酶变性,因此要控制好搅拌速度,防止剧烈的搅拌引起的酶的变性。
(5)添加保护剂 在酶提取过程中,为了提高酶的稳定性,防止酶变性失活,可以加入适量的酶的底物以及某些抗氧化剂等保护剂。
(三)分离纯化方法的评判
提纯的目的,不仅在于得到一定量的酶,而且要求其中不含或尽量少含其他杂质蛋白。在纯化过程中,除了要测定一定体积或一定质量的制剂中含有多少酶活力单位外,还要测定酶制剂的纯度。酶的纯度可用酶的比活力来衡量。
评价分离提纯方法优劣,常采用活力回收(也称回收率或产率)和比活力的提高倍数(也称纯化倍数)两个指标。
回收率(%)=每次总活力/第一次总活力
提高倍数=每次比活力/第一次比活力
总活力的回收率反映了提纯过程中酶活力的损失情况,而比活力的提高倍数则反映了纯化方法的有效程度。纯化后比活力提高越多,总活力损失越少,则纯化效果越好。一个酶的纯化过程常常需要经过多个步骤,若每一步平均使酶纯度增加1~2倍,总纯度可高达数百倍,但回收率为百分之几到十几。实际上,总活力的回收率和比活力的提高倍数两者难以兼得,应根据具体情况作相应取舍。
四、酶的修饰改造技术
天然酶的缺陷在于易变性失活(如遇酸、碱、有机溶剂、热);容易受产物和抑制剂的抑制;工业反应要求的酸度和温度并不总是在酶反应的最适酸度和温度范围内;底物不溶于水,或酶的米氏常数过高;酶作为药物在体内的半衰期较短等。这些因素限制了酶制剂的应用。而酶的化学修饰扩大了酶制剂的应用范围,它是指利用化学手段将某些化学物质或基团结合到酶分子上,或将酶分子的某部分删除或置换,改变酶的理化性质,最终达到改变酶的催化性质的目的。通过酶的修饰,提高酶的稳定性,降低或消除酶分子的免疫原性。
(1)常用化学修饰剂 常用化学修饰剂包括:①糖及糖的衍生物,如右旋糖酐、右旋糖酐硫酸酯、糖肽、葡聚糖凝胶;②高分子多聚物,如聚乙二醇、聚乙烯醇;③生物大分子,如肝素、血浆蛋白质、聚氨基酸;④双功能试剂,如戊二醛、二胺;⑤其他,如固定化酶载体、糖基化试剂、甲基化试剂、乙基化试剂和小分子有机化合物。
(2)修饰方法 修饰方法分为修饰酶的功能基团、酶分子内或分子间进行交联、酶与高分子化合物结合等。
(3)修饰酶的特性 修饰酶的特性包括稳定性提高、抗各类失活因子的能力提高、抗原性消除、体内半衰期延长、最适酸度改变、酶化学性质改变、对组织分布能力改变。酶分子经过化学修饰后,并不是所有的缺点都可以克服,并且修饰的结果难以预测,今后应选用更多的、合适的修饰方法,如使用基因工程法、蛋白质工程法、人工模拟法和某些物理修饰法等,使酶的性质进一步改善。
五、酶和细胞的固定化
使用纯酶的缺点是只能使用一次,成本高,产品分离困难;酶溶液很不稳定,容易变性和失活。而固定化酶性能稳定,可反复使用,降低了成本,易与产品分离,简化下游操作。
(一)固定化酶的制备
所谓固定化酶,是指限制或固定于特定空间位置的酶,即经物理化学方法处理,使酶变成不易随水流失即运动受到限制,而又能发挥催化作用的酶制剂。制备固定化酶的过程称为酶的固定化。固定化所采用的酶,可以是经提取分离后得到的有一定纯度的酶,也可以是结合在菌体(死细胞)或细胞碎片的酶或酶系。
(1)固定化酶的特点 固定化酶的特点包括:①可多次使用,而且在多数情况下,稳定性提高;②反应后,酶与底物和产物易于分开,产物中无残留,易纯化,产品质量高;③反应条件易控制,可实现转化反应的连续化和自动控制;④酶利用率高,单位酶催化的底物量增加,用酶量减少;⑤比水溶性酶更适合于多酶反应。
(2)固定化酶的制备方法 固定化酶的制备方法很多,主要有载体结合法(物理吸附法、离子结合法、共价结合法)、交联法、包埋法(凝胶包埋法和微囊化包埋法)等。
(二)固定化细胞
将细胞限制或定位于特定空间位置的技术称为细胞固定化技术。固定化细胞既有细胞特性,也有生物催化剂功能,又具有固相催化剂的特点。其优点在于:①无须进行酶的分离纯化;②细胞保持酶的原始状态,固定化酶的回收率高;③固定化酶比细胞内酶稳定性高;④细胞内酶的辅因子可自动再生;⑤细胞本身含多酶体系,可催化一系列反应;⑥抗污染能力强。
细胞固定化技术是酶的固定化技术的延伸,但细胞的固定化主要适用于胞内酶,要求底物和产物容易透过细胞膜,细胞内不存在产物分解系统及其他副反应;若存在副反应,应具有相应的消除措施。固定化细胞的制备方法有载体结合法、包埋法、交联法及无载体法等。
(三)原生质体固定化
对微生物细胞和植物细胞进行处理,除去细胞壁可获得原生质体,将其包埋制成固定化原生质体,由于有载体的保护作用,原生质体的稳定性大大提高。而且除去了细胞壁的扩散屏障,从而克服固定化细胞的缺点,有利于生产而获得大量的发酵产物。固定原生质体一般采用凝胶包埋法。常用的有琼脂凝胶、海藻酸钙凝胶、角叉菜酸和光交联树脂等方法。
(四)固定化方法与载体的选择
(1)固定化方法的选择 酶和细胞的固定化方法很多,同一种酶或细胞采用不同的固定方法,制得的固定化酶或细胞的性质可能相似,也可能相差甚远。不同的酶或细胞也可以采用同一种固定方法,制得不同性质的固定化生物催化剂。因此,酶和细胞的固定化需要根据具体情况和试验摸索出具体可行的方法。应考虑下述几种因素:①固定化酶应用的安全性;②固定化酶在操作中的稳定性;③固定化的成本。
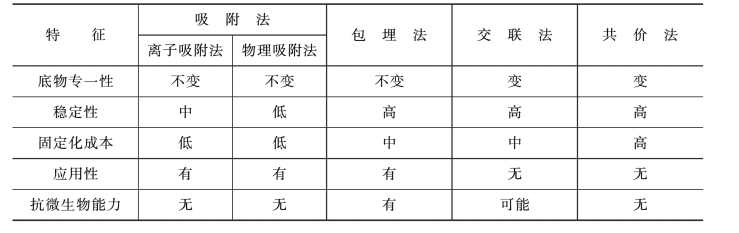
(2)载体的选择 为了工业化应用,最好选择在工业化生产中已大量应用的廉价材料为载体,如聚乙烯醇、卡拉胶及海藻胶等。离子交换树脂、金属氧化物及不锈钢碎屑等,也都是有应用前途的载体。此外,载体的选择还应考虑底物的性质。当底物为大分子时,不宜选用包埋型的载体,只能用可溶性的固定化酶;若底物不完全溶解或黏度大,宜采用密度高的不锈钢碎屑或陶瓷等材料制备吸附型的固定化酶,以便实现转化反应和回收固定化酶。各种固定化方法和特性的比较列于表1-1-2中。
表1-1-2 固定化方法及其特性的比较
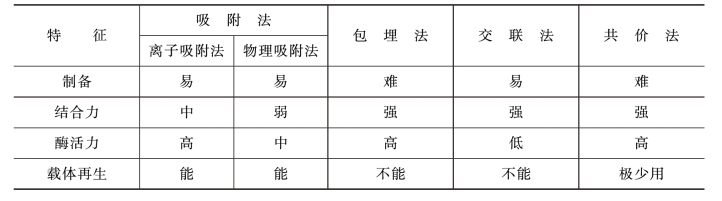
续表
六、酶反应器
(一)酶反应器的特点
以酶作为催化剂进行反应所需的设备称为酶反应器。其作用是以尽可能低的成本,按一定的速度由规定的反应物制备特定的产物。酶反应器的特点如下:在低温、低压的条件下发挥作用,反应时耗能和产能也比较少。它不同于发酵反应器,因为它不表现自催化方式,即细胞的连续再生。但是酶反应器和其他反应器一样,都是根据产率和专一性来进行评价的。
(二)酶反应器的基本类型和特征
酶反应器有两种类型:一类是直接应用游离酶进行反应的均相酶反应器;另一类是应用固定化酶进行的非均相酶反应器。均相酶反应能在分批式反应器或超滤膜反应器中进行,而非均相酶反应则可在多种反应器中进行。酶反应器的种类很多(见图1-1-12),应用时大致可根据催化剂的形状来选用。例如:粒状催化剂可采用搅拌罐、固定化床和鼓泡塔式反应器;细小颗粒的催化剂则宜选用流化床;对于膜状催化剂,则可考虑采用螺旋式、转盘式、平板式、空心管式膜反应器。各反应器形式及其特征列于表1-1-3中。

图1-1-12 酶反应器的类型
1—间歇式搅拌罐;2—连续式搅拌罐;3—多级连续搅拌罐;4—填充床;5—带循环的固定床;6—列管式固定床;7—流化床;8—搅拌罐-超滤器联合装置;9—多釜串联半连续操作;10—环流反应器;11—螺旋卷式生物膜反应器
表1-1-3 各反应器形式及其特征
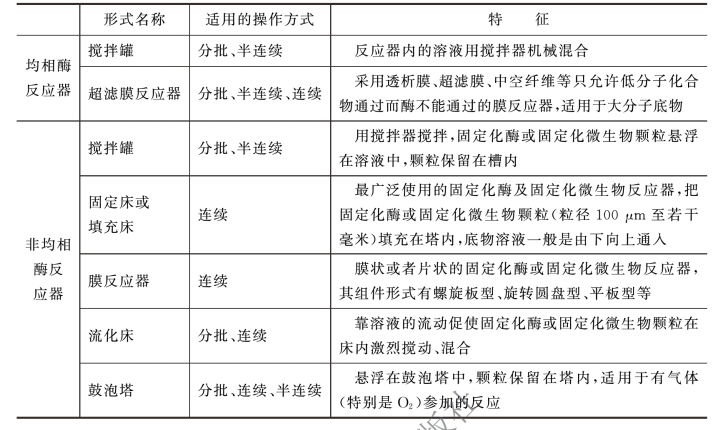
总之,在选用酶反应器形式时,必须综合考虑各种因素,具体包括:催化剂的形状和大小;催化剂的机械强度和相对密度;反应操作的要求(如pH是否可控制);防止杂菌污染的措施;反应动力学方程的类型;底物(溶液)的性质;催化剂的再生、更换的难易;反应器内液体的塔存量与催化剂表面积之比;传质特性;反应器制造成本和运行成本。
七、酶工程在医药工业中的应用
随着酶工业生产的发展,酶已在工业、农业、医药、环保等领域中广泛应用。酶在医药领域主要用于疾病的诊断、预防、治疗和制造药物。用于医药领域的酶具有种类多、用量少、效率高等特点。
(1)酶类药物 酶类药物包括:与治疗胃肠道疾病有关的酶类药物,如蛋白酶等;与治疗炎症有关的酶类药物,如蛋白酶、溶菌酶等;与溶解血纤维有关的酶类,如尿激酶、链激酶、纤溶酶等;具有抗肿瘤作用的酶类,如天冬酰胺酶、谷氨酰胺酶、神经氨基酸苷酶、尿激酶等;其他药用酶,如青霉素酶、透明质酸酶、弹性蛋白酶、激肽释放酶、超氧化物歧化酶(SOD)、右旋糖酐酶等。
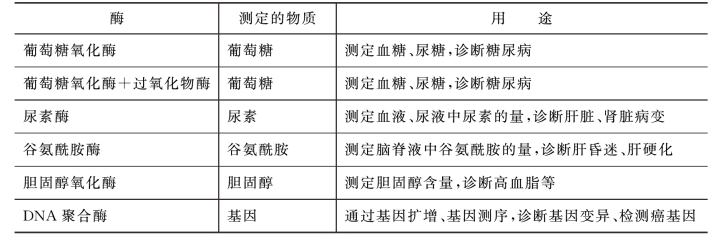
(2)诊断用酶 酶学诊断方法包括两个方面:一是根据体内原有酶活力的变化来诊断某些疾病;二是利用酶来测定体内某些物质的含量,从而诊断某些疾病(见表1-1-4)。有些酶(如胆固醇氧化酶等)还可固定化后制成酶电极或酶试纸,使用起来非常方便。
表1-1-4 用酶测定物质的量的变化进行疾病诊断
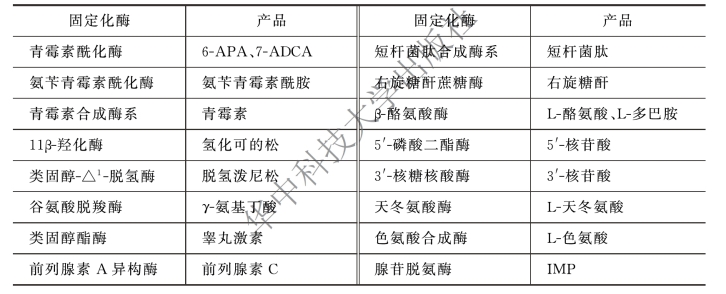
(3)现代酶工程技术在制药工业中的应用 酶在药物制造方面的应用是利用酶的催化作用将前体物质转变为药物,这方面的应用日益增多。现代酶工程技术具有技术先进、厂房设备投资小、工艺简单、能耗低、产品收得率高、效率高、效益大、污染轻微等优点。表1-1-5列出了一些固定化酶的应用。
表1-1-5 固定化酶及其相应产品
有关生物制药工艺(第2版)的文章

基因工程又可称为重组DNA技术、分子克隆技术、基因的无性繁殖、基因操作、基因克隆技术。(三)基因工程载体能够将外源DNA载入宿主细胞进行复制、整合或表达的工具称为载体。基因工程载体按照其用途大致可分为克隆载体和表达载体。目前克隆载体主要有质粒、噬菌体、柯斯质粒及人工染色体等。......
2023-06-24

研究内容包括微生物制药用菌的选育、发酵以及产品的分离和纯化工艺、质量控制等。发酵制药的基本过程就是利用制药微生物,通过发酵培养,使之在一定条件下生长繁殖,同时在代谢过程中产生药物,然后从发酵液中提取分离、纯化精制,获得药品。培养基的组成和比例是否恰当,直接影响微生物的生长、生产和工艺选择、产品质量和产量等。......
2023-06-24

生物化学药物由于其原料为动植物器官或组织,也要经过下游操作实现对目标物的获取。实际上,化学制药及中药生产过程中,也存在分离纯化的过程,并直接影响整个生产质量,因此,生物制药下游技术是通用于目前制药过程的操作技术,只是由于分离纯化原料不同,实际操作过程中会有差异。其技术水平和发展趋势对生物化学药物的发展产生重要的影响,常被称为生物工程的下游技术。......
2023-06-24

实验二十九组织块培养技术1.实验目的学会组织块的培养技术,观察组织块的组织学生长行为。组织块法特别适合于组织量少的原代培养,但组织块培养时细胞生长较慢,耗时较长。注意有无污染,已贴壁的组织块边缘有无细胞“长”出。组织块的取材要尽可能快,以免组织块因取材时间过长引起细胞状态不好,将会导致后期培养。......
2023-12-07

(三)具有代表性的生物化学药物目前应用于临床的生物化学药物很多,主要集中在氨基酸、肽、蛋白质、酶及辅酶、多糖、脂质、核酸及其降解产物等。目前已生产应用的人体来源生物化学药物主要有血液制品类、人胎盘制品类和人尿制品类。......
2023-06-24

实验六动物药物卵磷脂制备1.实验目的学习脂类药物的制备方法。磷脂类药物在临床上应用的主要有卵磷脂及脑磷脂,二者都有增强神经组织及调节高级神经活动作用,又是血浆脂肪良好的乳化剂,有促进胆固醇及脂肪运输作用,临床上用于治疗神经衰弱及防止动脉粥样硬化。......
2023-12-07

既然调整心态、自我激励对执行效率的提高有如此重要的作用,那么,具体该如何做呢?在实际执行过程中,我们会遇到困难或问题,此时难免会有很多的负面情绪或打击,在遇到这些打击后,心态可能会变得消极,这时,我们就需要学会将情绪化为力量,将自己的注意力转移到踏踏实实的行动中,从取得的小成就中慢慢找回自信。感受并分析“将情绪化为力量”的激励原理。......
2023-07-26

■顾圆圆谢挺说起大制药厂,相信很多人会找回曾经的记忆。大制药厂最先叫作镇海县制药厂,因为厂址在大,所以很多人习惯称作大制药厂。※大制药厂原址20世纪80年代,制药厂逐渐发展并迎来了销售高峰,生产的葡萄糖吊瓶、肌苷口服液等产品受到了医院和消费者的欢迎。大输液的制作要求比较高,一瓶检验出来不合格,那么这一批都得报废,所以生产大输液时期药厂并不是特别有利润。......
2023-09-27
相关推荐