金属材料大气腐蚀的机理主要是金属材料受到大气所含水分、氧气和腐蚀性介质的共同作用而引起的电化学破坏。对于潮大气腐蚀,腐蚀过程主要是阳极过程控制。当表面含NaCl的Q235钢暴露于含SO2的大气中时,由于NaCl和SO2各自的加速作用,其腐蚀速率将分别大于两者单独存在时的速率。......
2023-06-22
金属在常温空气中的腐蚀称为大气腐蚀。约有80%的金属构件是在大气条件下工作的,即使是化工厂,其所有金属的表面积也有70%暴露在大气之中,至于电力设备则绝大多数都处在大气环境中。总的金属腐蚀损失中约有一半以上是大气腐蚀造成的。
大气腐蚀属于电化学腐蚀的范畴。因为它具备电化学腐蚀的三个条件:①具有电位不同的阴、阳极;②有湿气或凝露形成的电解液;③相互间能构成电回路。它与其他电化学腐蚀的主要差别是,大气腐蚀时的电解液仅仅是金属表面上形成的水膜,因此大气腐蚀的特性与金属表面上水膜的性质有着密切的关系,腐蚀速度及危害程度主要取决于大气中的水分含量。
大气中水分含量用湿度表示,包括绝对湿度和相对湿度。
1)绝对湿度是指1m3大气中的水气含量,单位为g/m3。一定温度下大气的最高绝对湿度叫作大气的饱和水蒸气量,它随温度升高而增大。
2)相对湿度是指大气中的绝对湿度与同温度下的饱和水蒸气量之比,以RH表示。显然,大气的相对湿度与含水量及温度均有关系。
1.金属表面水膜的形成
大气腐蚀之所以能够发生,首先由于金属表面上有水膜形成。水膜的形成主要有以下几种原因。
1)由于天气原因如雨、雪、雾、露,或者由于水溅到金属表面而形成的水膜,水膜厚度约为1mm,肉眼就可以分辨出金属上存在一层水膜。
2)饱和凝露,水膜厚度为20~30μm,肉眼可见。当空气中的相对湿度RH>100%时,即可以在金属表面凝结成水膜。理论上当RH<100%时,不能凝露,但由于空气中日夜之间的温度差,也能达到凝露的条件。例如,当温差达6℃时,RH在65%~75%时就能凝露;当温差达15℃时,RH在25%~35%时就能凝露。我国大部分地区昼夜温差都在10℃以上,因此都有凝露的条件。
3)形成水膜的其他原因,水膜厚度一般小于1μm,肉眼不可见,包括以下方式:
①毛细凝聚。裂缝、缝隙、杂质或腐蚀产物堆积处都可形成毛细凝露,一般毛细孔越小,越易凝聚。毛细管曲率半径在2.1×10-7cm时,RH在59%时就可凝露;毛细管曲率半径在1.2×10-7cm时,RH在39%时就可凝露。
②吸附凝聚。一般固体物质表面都能吸附水分子而形成一层薄的水分子层。在RH为55%时,金属表面可吸附15个分子厚的水分子层。
③化学凝聚。当金属表面含有能与水形成水合物的盐类时,对水分子的吸附力更强,这就是化学凝聚。如含NaCl的金属表面,RH在76%时就能凝露;含CaCl2的金属表面,RH只需32%就能凝露。所以,金属物上沾有手汗(钠盐和铵盐),易引起吸湿凝聚而导致腐蚀。
④水膜中的电解质。空气中的CO2、动植物腐败产生的NH3和H2S、电解质尘埃、雷雨时生成的NO2、沿海地区的海水飞沫、盐雾、工业大气中的SO2和Cl2等都能溶入金属表面的水膜中,因而形成了电解液。所以,大气腐蚀是液膜下的电化学腐蚀,其腐蚀反应是在金属表面上极薄的一层电解液膜下进行的。
2.大气腐蚀的类型
根据大气干湿的程度,大气腐蚀可分为干的、潮的、湿的三种类型。
(1)干的大气腐蚀 这是金属在干燥大气中进行的一种腐蚀,在金属表面上没有水膜,只有几个分子层的吸附膜,还不具有电解液的性质,所以属于化学腐蚀的范畴。腐蚀是靠空气中氧等气体与金属发生化学反应而进行的。反应结果生成一层肉眼不可见的氧化膜。
在常温下,此类反应的反应速度很小,膜厚的增长与时间成对数关系,如Fe在干燥洁净的空气中,在室温下膜的极限厚度只有30~40Å(1Å=10-10m)。但当空气中含有硫化物等杂质时,膜可能增长得相当厚,以致金属表面发暗,影响到产品的质量。如果大气非常干燥的话,即使含有硫化物,腐蚀速度也能很快变慢而趋于停止。
(2)潮的大气腐蚀 金属在RH<100%的大气中的一种腐蚀,此时水蒸气浓度必须超过某一最小值(临界湿度)。在这种情况下,金属表面上有一层肉眼不可见的水膜,其厚度在100Å~1μm,虽然很薄,但已具有电解液的性质,所以属于电化学腐蚀。金属在薄层水膜中的电极反应与通常的电解液中金属腐蚀时的电极反应相似,但控制步骤不一定相同。
阳极过程是金属的溶解反应:
Me+nH2O→Me+·nH2O+e
在潮的大气腐蚀中,水膜很薄,金属表面存在的水分子很少,而在阳极反应中又必须生成水化离子,所以阳极过程将随着水膜的减薄而不易进行;其次,金属溶解生成的大量金属离子堆积在很薄的水膜中,致使浓差极化非常严重;再有,因为水膜薄,因此含氧丰富,溶解氧很易透过水膜而使阳极金属发生钝化,这些都能使阳极发生强烈的极化作用,因此潮的大气腐蚀中的阳极过程是腐蚀反应的控制步骤。
阴极过程主要是氧的去极化反应:
O2+4H++4e→2H2O(酸性水膜中)
O2+2H2O+4e→4OH-(中性、碱性水膜中)
因为水膜很薄,所以氧到达阴极很容易,但水分子太少也会使氧的去极化反应发生困难,即使得阴极极化作用增大,但其程度没有阳极极化作用那样大。
在潮的大气腐蚀中,经常处于干湿交替的状态,钢铁表面的锈层常常具有加速腐蚀的作用。当在潮湿状态时,锈层可以与溶解氧一起作为阴极去极化剂。
3Fe2O3+H2O+2e→2Fe3O4+2OH-
但当处于干燥状态时,含氧量很丰富,Fe3O4又能被重新氧化:
4Fe3O4+O2→6Fe2O3
因此,在干湿交替的条件下,带锈的钢铁可加速腐蚀。
(3)湿的大气腐蚀 金属在RH接近于100%的大气中进行的一种腐蚀,水分在金属表面上成滴凝聚,水膜厚度在1μm~1mm,属于电化学腐蚀。因为水膜较厚,阳极反应易于进行,腐蚀过程基本上由阴极过程控制,氧的扩散速度是主要的控制步骤。

图2-1 Fe在0.1mol/L的NaCl溶液和水膜中的阴极极化曲线
1—溶液中 2—330μm厚的水膜中 3—165μm厚的水膜中 4—100μm厚的水膜中
图2-1是Fe在0.1mol/L的NaCl溶液和水膜中的阴极极化曲线,当电流密度不大时,各阴极极化曲线很靠近,表明电流密度与水膜的厚度关系不大,因这时的电流密度主要取决于氧的还原反应速度,所以图上曲线的靠近表明氧的还原反应速度不论在溶液中还是在不同厚度的薄膜中,都是很容易进行的。
在电流密度较大时,各极化曲线很不一致,表明电流密度与水膜厚度有关。在同一电位下,阴极极化的电流密度随水膜厚度的降低而迅速增加。因为电流密度较大,阴极过程的速度取决于氧的扩散速度。这也表明,随着水膜厚度的减小,极限扩散电流密度增大了,而阴极极化性能降低了,即在薄层水膜中,阴极过程的控制步骤是氧的扩散过程,而氧的还原反应是容易进行的。
3.影响大气腐蚀的因素
影响大气腐蚀的因素有很多,季节、风向、气候区类、大气成分等都对大气腐蚀有显著影响,主要影响因素有以下几点。
(1)相对湿度的影响 湿度直接影响金属表面上液膜的形成和保持时间,所以对大气腐蚀的影响最大。某种金属在腐蚀时都有一个临界湿度,低于临界湿度时,金属表面上没有水膜,受到干的大气腐蚀,属于化学腐蚀,因此腐蚀速度很小。高于临界湿度时,由于水膜的形成,化学腐蚀转变为电化学腐蚀,腐蚀速度突然增大。
临界湿度取决于金属的种类,一般钢铁的临界湿度为65%~75%;临界湿度也取决于表面状态及表面污染情况,金属表面越粗糙,裂缝和小孔越多,临界湿度越低;金属表面沾上易于吸潮的盐类或灰尘,临界湿度也越低。
(2)温度和温度变化的影响 一般来说,温度的影响没有相对湿度的影响大,只有在高温雨季时,温度才会起较大的作用。温度的影响具有两重性,当温度升高但不改变大气腐蚀的类型时,由于阴、阳极反应速度增大而加快腐蚀速度。而当绝对湿度不变时,温度升高将会降低相对湿度,使水膜减薄,如果温度升高使相对湿度跨越临界相对湿度,将会使潮的大气腐蚀变为干的大气腐蚀,这样就会急剧降低腐蚀速度。
相对来说,温度的变化比温度本身的影响要大得多,温度的突然变化往往促使金属凝聚水膜,造成严重的大气腐蚀。因此生产与贮存金属产品的工厂或仓库,应尽可能地避免剧烈的温度变化。
(3)大气成分的影响 大气中存在的尘埃和有害性气体对腐蚀有很大的影响。尘埃沉积于金属表面会形成缝隙,大气中的水分易于在此凝聚,尘埃中含有的碳粒、NaCl、(NH4)2SO4等进一步吸水并增强了水膜的腐蚀性。
工业大气中危害最大的是SO2,SO2能增加金属腐蚀速度的原因是:
1)SO2是腐蚀反应阳极过程的活化剂,它先与金属表面的Fe和O2一起生成FeSO4,然后进一步得到H2SO4并加速Fe的阳极溶解过程,其反应式为
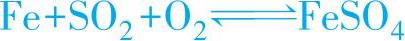
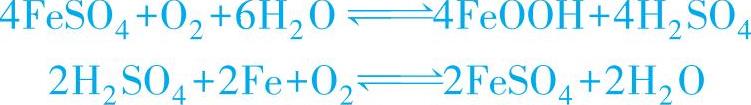
这就是SO2腐蚀的酸性再生机理,在此FeSO4仅起催化剂的作用,所以SO2有破坏金属表面的保护膜,使阳极过程容易进行的作用。
2)SO2在水中的溶解度是O2的1300倍,溶解后使水膜的pH值下降,因此虽然SO2在大气中的浓度比O2小得多,但由于溶解度高,甚至能使它比溶解氧的阴极反应更有效。
3)SO2本身也是一个强的阴极去极化剂,在阴极上可发生如下还原反应:
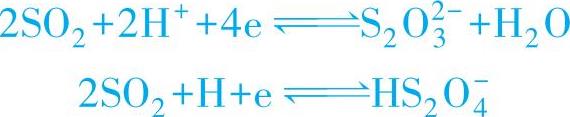
以上反应使阴极过程也更容易进行。
4.大气腐蚀的防止措施
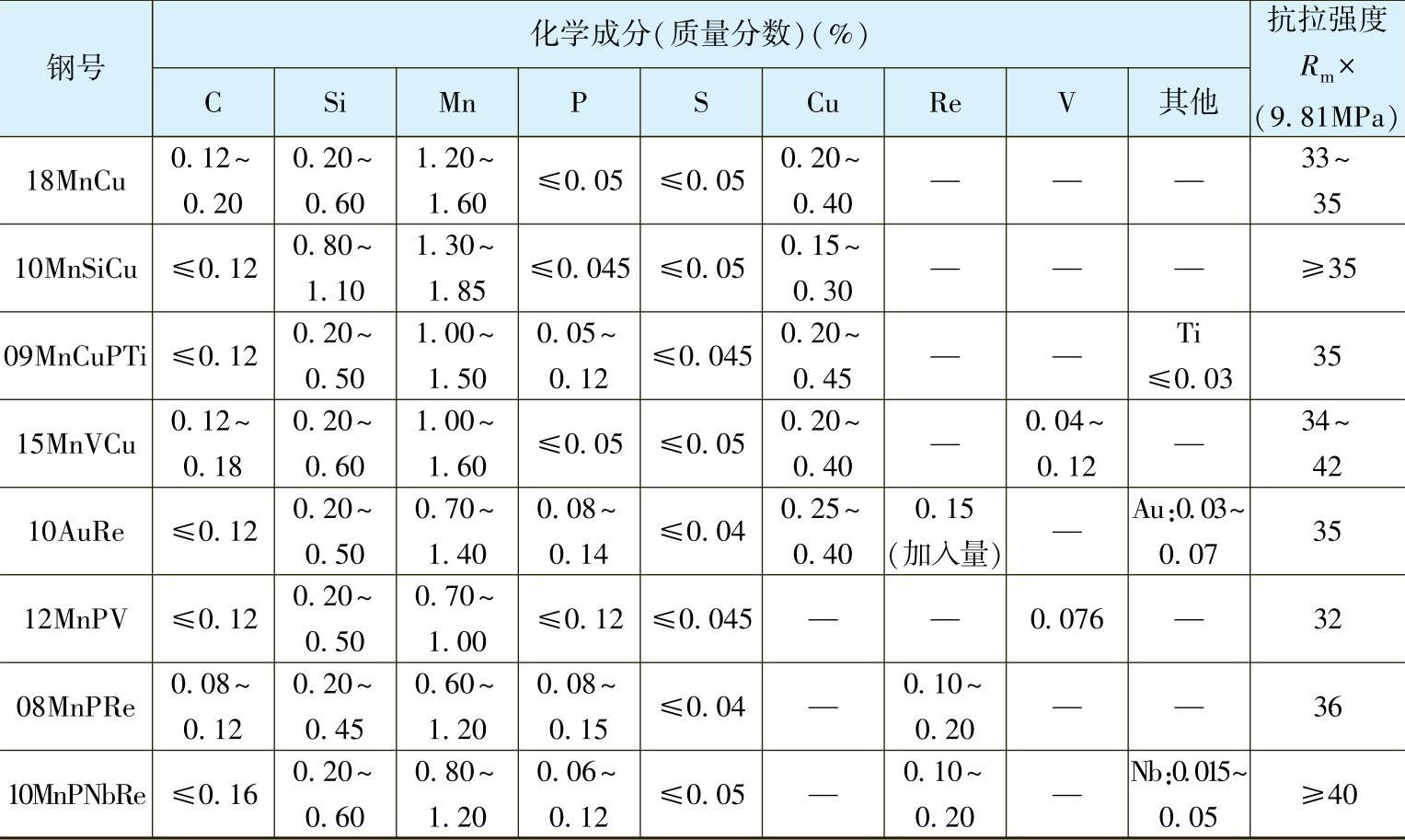
(1)添加合金元素 钢中加入少量Cu、P、Cr、Ni等元素后能提高耐大气腐蚀的性能。如Cu质量分数为0.3%~0.8%的钢具有很好的耐海洋大气性能,Cu是作为阴极极性元素加入的,因大气腐蚀中氧浓度很大,对钢材很易达到钝化临界浓度,铜的加入可加速钝态的实现。表2-1列出了我国主要耐大气腐蚀的低合金钢。
表2-1 我国主要耐大气腐蚀的低合金钢
(2)采用有机、无机涂层或金属镀层 最经济而简单的办法是涂漆,氯磺化聚乙烯涂料、PF-01涂料、G-615防腐漆、氯醋涂料等都是很好的防大气腐蚀涂料。
(3)降低相对湿度 采用加热空气、干燥剂、冷冻除水等方法将相对湿度控制在临界值以下,也就是把大气腐蚀控制在干大气腐蚀的低速率之内。这种方法常用于金属材料及制品的库房管理中。
(4)缓蚀剂 在保管、运输、加工过程中,人们广泛应用多种油溶性缓蚀剂、水溶性缓蚀剂和气相缓蚀剂,制成各种防锈液或防锈包装材料,都可有效抑制或减缓大气腐蚀的发生和发展。
(5)其他 其他如净化空气、擦拭金属表面、清除表面附着物等也有助于减轻大气腐蚀的危害。
有关电力系统金属材料防腐与在线修复技术的文章

金属材料大气腐蚀的机理主要是金属材料受到大气所含水分、氧气和腐蚀性介质的共同作用而引起的电化学破坏。对于潮大气腐蚀,腐蚀过程主要是阳极过程控制。当表面含NaCl的Q235钢暴露于含SO2的大气中时,由于NaCl和SO2各自的加速作用,其腐蚀速率将分别大于两者单独存在时的速率。......
2023-06-22

镍在大气中的腐蚀速率与暴露时间和室外SO2的平均浓度有线性关系。这层膜是良好的绝缘体,并有良好的抗大气腐蚀能力。与其他金属不同,在H2S存在时,也不能确定有NiS产生,大气中的HCl和CH3C1也是相对惰性的。镍与其他金属相比,耐大气腐蚀性好,而且其腐蚀过程也比较简单。悬浮颗粒、降水等物质中的SO2、SO42-是镍在大气腐蚀中的重要因素。......
2023-06-22

虽然大气中SO2含量很低,但它在溶液中的溶解度比氧气约高1300倍,对腐蚀影响很大。H2S气体在干燥的大气中会使铜变色,在潮湿大气中会加速铜、镍、镁以及铁的腐蚀。中性盐类对金属腐蚀的影响取决于很多因素,如腐蚀产物的溶解度、阴离子的特性,特别是氯离子。所以不同大气环境中的不同污染物质对大气腐蚀有着不同的影响。此外,当表面存在污染物质,会吸附有害杂质更进一步促进腐蚀的进程,故金属表面的清洁度对腐蚀也有明显的影响。......
2023-06-22

只有在电解液层很厚的湿大气腐蚀,并且电解液层中盐的浓度较高时,才有可能发生阴极析氢过程。金属在大气环境中的腐蚀涉及大气环境、表面状态和组织结构等多方面因素。大气环境的相对湿度和温度是影响金属大气腐蚀行为的主要因素,当金属表面存在电解液膜后,使得金属从化学腐蚀转化为电化学腐蚀。......
2023-06-22

通过在实验室建立潮湿和湿热两种大气环境,对纯铁和碳钢在模拟大气环境中初期腐蚀行为进行研究。尽管对碳钢和耐候钢在大气环境中形成的锈层的结构、组成以及生长动力学了解较多,但对初期的腐蚀行为了解得并不多。耐候钢相对于碳钢来说,有较好的耐大气腐蚀的性能,其原因是在表面形成了一层致密的氧化层,阻碍了腐蚀介质的进入。在含SO2的污染大气中,SO2可促进锈层状态的转变。......
2023-06-22

酸雨腐蚀建筑材料、金属结构、油漆等。美国国家地表水调查数据显示,酸雨造成75%的湖泊和大约一半的河流酸化。欧洲和北美国家经受多年的酸雨危害之后,认识到酸雨是一个国际环境问题,单独靠一个国家解决不了问题,只有各国共同采取行动,减少二氧化硫和氮氧化物的排放量,才能控制酸雨污染及其危害。目前,欧洲、北美的国家以及日本等在削减二氧化硫排放方面取得了很大进展,但控制氮氧化物排放的成效尚不明显。......
2023-11-17

金属在大气条件下发生腐蚀的现象,是最普遍的一种环境腐蚀形式。根据大气腐蚀的发生情况,我国大致可分为5种区域类型。多数情况下,大气腐蚀是由于潮湿的气体在物体表面形成一薄层液膜而引起的。金属材料在不直接被雨淋时发生的腐蚀破坏就是潮大气腐蚀的例子。......
2023-06-22

与机械零件发生化学反应的有害物质主要是气体中的O2、H2S、SO2等及润滑油中某些腐蚀性产物。腐蚀疲劳承受交变应力的金属机件,在腐蚀环境下疲劳强度或疲劳寿命降低,乃至断裂破坏的现象,称为腐蚀疲劳或腐蚀疲劳断裂。......
2023-06-22
相关推荐