在1.1节的基本概念里,已经了解了电极是指金属与电解液组成的体系,即电子导体和离子导体组成的体系。然而,绝对电极电位无法测量,必须借助于参比电极与该电极组成原电池,才能通过仪器测量原电池的电动势来得到。......
2023-06-23
平衡电位的数值反映了物质的氧化还原能力,可以用来判断电化学反应进行的可能性。平衡电位的数值与反应物质的活度有关,有H+或OH-离子参与的反应,电极电位将随溶液pH值的变化而变化。因此把各种反应的平衡电位和溶液pH值的函数关系绘制成图,就可以从图上清楚地看出一个电化学体系中,发生各种化学或电化学反应所必须具备的电极电位和溶液pH值条件,也可以判断在给定条件下某化学反应或电化学反应进行的可能性。这种图称为电位-pH图,或称为φ-pH图。
φ-pH图是比利时Pourbaix教授首先提出使用的,它是根据热力学方法,综合考虑了氧化还原电位和溶液pH值影响的平衡状态图。图中明确表示出在某一电位和pH值条件下,体系的稳定物或平衡状态,故可用于判断腐蚀的倾向和估计腐蚀产物。φ-pH图既可以反映一定电位和pH值时金属的热力学稳定性及其不同价态物质的变化倾向,又能反映金属与其离子在水溶液中的反应条件,所以在金属与防护领域占有重要地位。铁的腐蚀是最常见的金属腐蚀,下面就以Fe-H2O体系为例介绍φ-pH图。
1.Fe-H2O体系的φ-pH图
绘制Fe-H2O体系的φ-pH图通常包括以下步骤:
1)确定Fe-H2O体系中可能发生的各类反应,列出各反应(或主要反应)的平衡方程式。
2)根据参与反应的各组分的特性和热力学数据,通过查表或计算出电极反应的标准电位数值。
3)根据指定的离子活度(或气体分压)、温度等条件,计算出各反应的平衡条件。
4)将每个反应的计算结果表示在以φ为纵坐标、pH值为横坐标的φ-pH图上。
Fe-H2O体系中可能存在的各组分之间相互反应和平衡条件见表1-7。
表1-7 Fe-H2O体系中可能存在的各组分之间的相互反应和平衡条件(25℃)
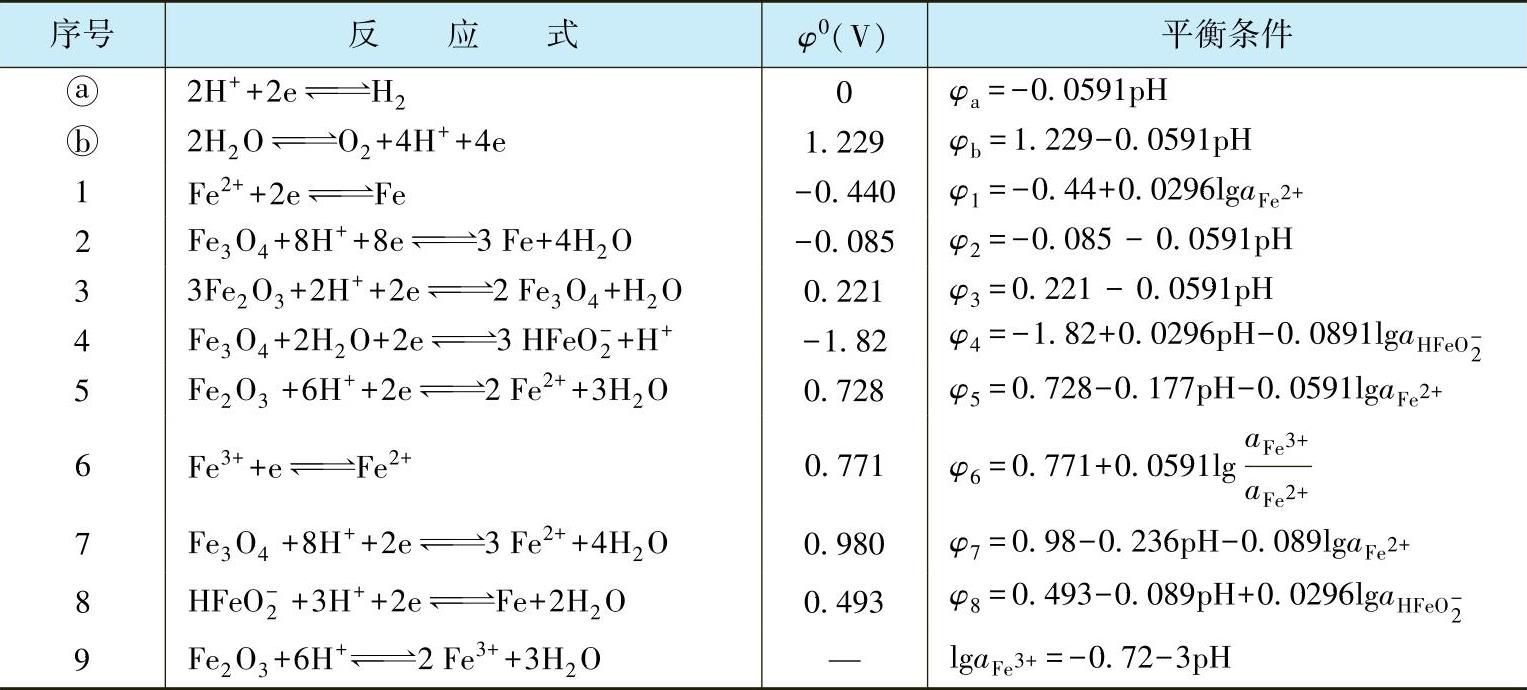
归纳起来,表1-7中的反应可以分为三种类型。
(1)没有H+或OH-参与的氧化还原反应 如表1-7中的反应式1和6。查表1-7可得它们的平衡条件分别为
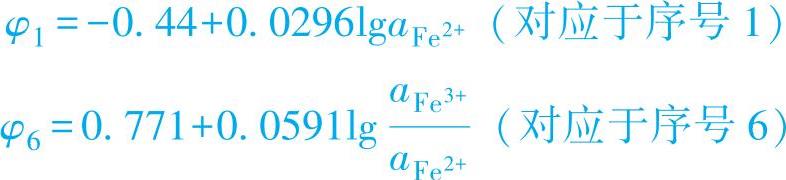
这类反应的特点是反应的平衡电位与溶液中的pH值无关,只与溶液中参与反应的离子活度有关,指定
 =
= =10-6mol/L,可得
=10-6mol/L,可得
φ1=-0.6176V
φ6=0.771V
反映在φ-pH图上就是两条与pH轴平行的水平直线,如图1-18中编号为①和⑥的直线。在①号线以下Fe2+有还原为Fe的趋势,在⑥号线以上Fe2+有氧化为Fe3+的趋势,而在①号线和⑥号线之间则Fe有氧化为Fe2+的趋势,而Fe3+有还原为Fe2+的趋势。
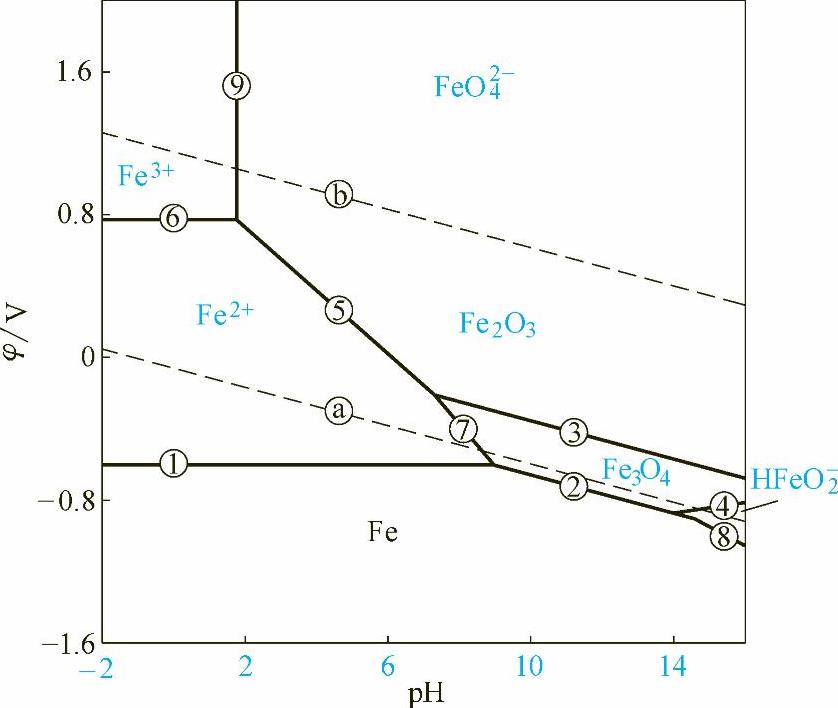
图1-18 Fe-H2O体系的部分φ-pH图(25℃)
指定不同的 与
与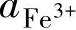 值,就可以得到分别平行于①号线和⑥号线一簇平行线。
值,就可以得到分别平行于①号线和⑥号线一簇平行线。
(2)有H+或OH-参与的非氧化还原反应 如表1-7中反应式9。

该反应并不包含电子的得失,显然平衡电位的变化不会对反应造成影响,因此可以用平衡常数K来求出离子浓度与pH值之间的关系:
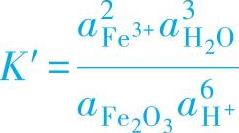
可以把固态物质Fe2O3和溶剂水的活度看作是1,反应式(1-26)的平衡常数为

将式(1-27)两边取对数,得

根据热力学数据可以求得平衡常数K=0.0362,于是可得

该式与φ无关,平衡时pH值与离子活度有对应关系,故在φ-pH图中是一条平行于φ轴的垂直线。
假设 =10-6mol/L,则代入式(1-28)可得pH=1.76,即图1-18中的⑨号线。在⑨号线的左边,即pH<1.76时,Fe2O3有被酸溶解的趋势;在⑨号线的右边,即pH>1.76时,溶液中的Fe3+有转化为Fe2O3的趋势。
=10-6mol/L,则代入式(1-28)可得pH=1.76,即图1-18中的⑨号线。在⑨号线的左边,即pH<1.76时,Fe2O3有被酸溶解的趋势;在⑨号线的右边,即pH>1.76时,溶液中的Fe3+有转化为Fe2O3的趋势。
指定不同的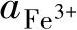 ,就可以得到平行于⑨号线的一簇平行线。
,就可以得到平行于⑨号线的一簇平行线。
(3)有H+和OH-参与的氧化还原反应 这类反应最多,如表1-7中的反应式2、3、4、5、7、8等。这类反应的平衡电位与溶液的pH值有关,以反应式5为例:
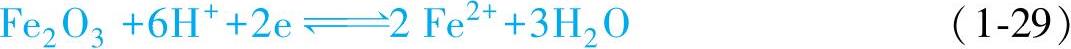
根据能斯特方程可以得到反应式(1-29)的平衡电位为

假设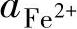 =10-6mol/L,代入式(1-30)可得
=10-6mol/L,代入式(1-30)可得
φ5=1.083-0.177pH
反映在φ-pH图上就是一条斜率为-0.177的斜线,即图1-18中的⑤号线。
按照同样的方法,可以在φ-pH图上作出⑦号线、②号线、③号线、④号线和⑧号线,分别对应于表1-6中的反应式7、2、3、4和8。
因为金属腐蚀绝大多数情况下都是以水溶液为电解液的,因此在金属的φ-pH图上总要绘出水的φ-pH图。在图1-18中虚线ⓐ和ⓑ即为水的φ-pH图线,分别代表表1-7中反应(a)和(b)在氢分压和氧分压都为1atm下的平衡条件。所以ⓑ线之上是氧的稳定存在区,ⓐ线以下是氢的稳定存在区,在ⓐ、ⓑ线之间不可能分解出H2和O2,是水的热力学稳定区。
2.φ-pH图的应用
在腐蚀学中,人为规定可溶性物质在溶液中的浓度小于10-6mol/L时,它的溶解度可视为无限小,即可把该物质看成是不溶解的。因此,在金属的φ-pH图中,假定可溶性离子浓度为10-6mol/L时得到的平衡线就可以作为金属腐蚀与不腐蚀的分界线。这样就得到了简化了的φ-pH图,又称为金属腐蚀图。图1-19所示的是Fe的腐蚀图,该图可被划分为三种类型的区域。
(1)稳定区 该区域内铁处于热力学稳定状态,不发生腐蚀。图1-19所示的稳定区是铁和氢的稳定区域,在该区域内铁不会腐蚀,但H+可还原为H原子或氢分子。在该区域所包含的电位和pH值条件下,铁不会被腐蚀,但铁表面会有氢气析出,因而存在渗氢和产生氢脆的可能性。

图1-19 Fe的腐蚀图
(2)腐蚀区 该区域内稳定存在的是铁的各种可溶性离子,如Fe2+、Fe3+和HFeO-2等离子。如果铁处于图1-19中的A位置,在该电位和pH值条件下,体系中将发生如下反应:
阳极反应:Fe→Fe2++2e
阴极反应:2H++2e→H2↑
腐蚀电池反应:Fe+2H+→Fe2++H2↑
因此铁将发生析氢腐蚀。由于有氢原子或氢分子形成,故也有渗氢和氢脆的可能性。
若铁处于图1-19中的位置B,这时的电位高于a线,低于b线,因此不会发生析氢反应,而将发生氧的还原反应,即
阳极反应:Fe→Fe2++2e
阴极反应:2H++1/2O2+2e→H2O
腐蚀电池反应:Fe+2H++1/2O2→Fe2++H2O
铁的这种腐蚀过程称为吸氧腐蚀。
(3)钝化区 该区域内稳定存在的是难溶性的铁的氧化物或氢氧化物,如Fe2O3和Fe3O4[或Fe(OH)2和Fe(OH)3]。如果这些固态物质能够牢固地覆盖在铁的表面,则铁将被保护而免于腐蚀。
从图1-19可知,铁在pH值为5~9之间的中性电解液中会发生腐蚀,因为它正好处于腐蚀区内,如图1-19中的位置A。如果能将铁所处的位置移出腐蚀区,就能达到防止腐蚀的目的,因此根据φ-pH图,可以采取下列措施:
1)调节介质的pH值。由图1-19可知,若将电解液的pH值调整到9~13之间,铁就不会被腐蚀,因为在这种情况下,当电位较低时落在稳定区,电位较高时,由于铁表面生成Fe2O3和Fe3O4钝化膜而进入钝化区。根据这一原理,为了防止钢铁在工业用水中的腐蚀,常常加入一些碱,使水溶液的pH值在9~13之间。但电解液的碱性也不能过高,以免生成可溶性的HFeO2-离子,导致进入图1-19中右下方的小三角形腐蚀区内而遭到腐蚀。
2)阴极保护。当电解液的pH值在0~9之间时,可以将铁的电位降低到Fe2+/Fe的平衡电位-0.6V以下,则可进入稳定区,使铁免遭腐蚀。一种方法是把要保护的金属构件与直流电源的阴极相连,使被保护金属的整个表面变成阴极,以达到保护金属的目的,这就是阴极保护法。另一种方法是将要保护的金属与更活泼的金属相连组成原电池,活泼金属作为阳极而被加速腐蚀掉,而被保护金属则作为阴极得到了保护,这就是牺牲阳极法。这两种方法用来防止金属设备在海水或河水中的腐蚀非常有效。
3)金属钝化。当将铁的电位沿正方向升高到钝化区时,则金属表面被一层氧化物保护膜所覆盖,也可以达到防护的目的。钝化的方法之一是将铁作为阳极,通以一定的直流电使其发生阳极极化,这称为阳极保护法。但更常用的方法是在溶液中加入阳极缓蚀剂或氧化剂(如铬酸盐、重铬酸盐、硝酸盐或亚硝酸盐等),使金属表面生成一层钝化膜。如将铬酸盐加入到电解液时,由于发生了下列反应:
6Fe2++2CrO24-+4H2O→3Fe2O3+Cr2O3+8H+
金属表面不仅生成了Fe2O3,还形成了新的具有保护作用的Cr2O3水合物固相,这样就扩大了钝化区,使本来是Fe2+稳定的腐蚀区大为缩小。
3.φ-pH图的局限性
φ-pH图是根据热力学数据建立起来的,因此与实际的电化学体系往往有较大的差别,所以在用φ-pH图解决实际问题时,必须注意它的局限性。φ-pH图的局限性主要表现在:
1)φ-pH图是一种热力学的电化学平衡图,因而只能给出电化学反应的方向和热力学可能性,而不能给出电化学反应的速度。
2)建立φ-pH图是以金属与电解液中的离子和固相反应产生之间的平衡作为先决条件的。但在实际体系中,可能偏离这种平衡。此外,φ-pH图也没有考虑“外部离子”对平衡的影响。如水溶液中往往存在Cl-、SO24-等离子,它们对电化学平衡的影响常常不能忽略。
3)φ-pH图的钝化区是以金属氧化物、氢氧化物或难溶盐的稳定存在为依据的。而这些物质的保护性能究竟如何,φ-pH图并不能直接反映出来。
4)φ-pH图中所表示的pH值是指平衡时整个电解液的pH值。而实际的电化学体系中,金属表面上各点的pH值可能是不同的。通常阳极反应区的pH值比整体电解液的pH值要低,而阴极反应区的pH值要高些。
有关电力系统金属材料防腐与在线修复技术的文章

在1.1节的基本概念里,已经了解了电极是指金属与电解液组成的体系,即电子导体和离子导体组成的体系。然而,绝对电极电位无法测量,必须借助于参比电极与该电极组成原电池,才能通过仪器测量原电池的电动势来得到。......
2023-06-23

图4.13[例4.7]电路图与相量图电路图;相量图解:方法一:..图4.13[例4.7]电路图与相量图电路图;相量图解:方法一:..方法二:当I最小时,电路的输入导纳Y最小,也即输入阻抗Z最大,有方法二:当I最小时,电路的输入导纳Y最小,也即输入阻抗Z最大,有故电流表A1的读数为10A。......
2023-06-24

我们把能够作为基准的,其电极电位保持恒定的电极叫作参比电极。将参比电极与待测电极组成一个原电池回路,如图1-4所示,所测出的电池端电压E叫作相对于该参比电极的相对电极电位,习惯上我们直接称作电极电位。通常所说的电极电位都是相对于某一参比电极的相对电极电位。表1-1常用参比电极的电极电位图1-5标准氢电极示意图我们规定NHE的电极电位在任何温度下都为零,它是测量一切电极电位的基准。表1-1常用参比电极的电极电位......
2023-06-23

离子转移后两相界面之间就会形成双电层,双电层之间的电位差即金属与电解液之间的电位差,就是金属的电极电位,记作φ,有时也用下标注明金属电极种类,如铜电极的电极电位记作φCu/Cu2+。反之,如果水化离子进入金属晶格,则金属表面带正电荷,因而形成的双电层具有正的电极电位。经过一定时间达到平衡后所具有的电极电位,叫作该金属的平衡电极电位,记作φe。标准状态下的平衡电极电位称作标准电极电位,用φ0表示。......
2023-06-23

上述三个特征值把日负荷图划分为三个区域,即峰荷区、腰荷区及基荷区。年负荷图表示一年内电力系统负荷的变化过程。一条是月最大负荷年变化曲线,依据每月最大负荷日的最大负荷值绘制,它表示电力系统各月所需的工作容量。图G6.5日负荷图电力系统的负荷,随着国民经济的发展是逐年增长的。......
2023-06-21

准规则斑图产生于数学模型与计算机绘图方法,具有独特的图形特点。显然,准规则斑图奇特新颖,极富美感与视觉冲击力,非人类大脑所能想象,无疑是弱混沌动力系统贡献给人类视觉艺术的一场盛宴!作为一种全新的艺术视图,准规则斑图在艺术设计方面已经开始受到设计人员的注意。这些工作均为准规则斑图在设计与工程技术领域的开发利用提供了有益的借鉴与参考,从而展示出了其广阔的应用前景。......
2023-10-17

电势滴定法获得成功靠的是一种应用方便的测量电势系统,这一系统自然与pH测定法的发展联系着的。氢电极作为一种参考电极,尽管测试范围很广并具有抗盐误差的性质,但也不是日常分析工作的一种方便易用的电极。氢醌电极测试范围狭窄,并与氢电极一样不能用于有氧化剂和还原剂存在的场合。这种电极又重新引起了人们对电势滴定法的注意。......
2023-11-24

6)无论是等电位联结还是局部等电位联结,每一电气装置外的其他系统可只连接一次,并未规定必须作多次连接。所以,在浴室范围内还需要用铜线和铜板作一次局部等电位联结。12)等电位联结内各联结导体间连接可采用焊接,也可采用螺栓连接或熔接。等电位联结端子板应采取螺栓连接,以便拆卸进行定期检测。......
2023-09-27
相关推荐