铝合金成分的影响 铝合金的化学成分,不仅对膜层的耐蚀能力有影响,而且对膜层厚度,外观颜色影响较大。在相同情况下纯铝得到的氧化膜比合金的氧化膜厚、色泽好。硅铝合金较难氧化,膜层发暗。杂质的影响 杂质主要是Al3+和Cl-、F-、NO3-离子。1)Al3+离子的影响。适当的Al3+对氧化膜形成有好处,但含量不能过高,否则电阻太大。电解液浓度的变化对膜在电解过程中的溶解产生很大的影响。......
2025-09-29
金属氧化后生成氧化膜,因此氧化膜的厚度就可以代表金属腐蚀的量,根据氧化膜的厚度随时间的变化,就可以知道金属的腐蚀速度以及氧化膜对腐蚀速度的影响。
金属氧化的速度主要取决于金属和氧在氧化膜中的扩散速度,扩散速度则与氧化膜的缺陷形式有关。不同金属,氧化膜的生长规律不同;同一金属在不同温度下氧化时,也会遵循不同的规律;即使同一金属在同一温度下,随着氧化时间的延长和氧化膜厚度的增加,膜生长的动力学规律也会发生变化。通常在低温和氧化膜较薄时,膜的生长规律符合对数关系、反对数关系或渐近线关系;在氧化膜较厚时,一般按抛物线关系或直线关系生长。
1.极薄氧化膜的生长规律
金属氧化时,首先是氧分子在金属表面上发生物理吸附,由于氧与电子的亲和力很大,吸附的氧原子形成O2-离子,致使金属表面带正电,于是在氧和金属界面上形成一个双电层。由于双电层的形成,产生了约107V/cm的极强电场,在此电场的作用下,能把金属离子从金属表面晶格中拉出,也能把氧离子吸入到金属晶格中。由于这样的物质移动,形成了三维的氧化物晶核。晶核先横向扩展,直至把整个表面覆盖后,再向厚度方向生长。由于这层氧化膜的存在,反应物必须通过膜内扩散才能到达反应地点。反应物在膜内移动的推动力就是膜中扩散粒子的浓度梯度,存在于膜上的电位梯度即电场强度。
在只有1~10nm极薄氧化膜的情况下,温度较低时离子的扩散离子移动的推动力主要是电位梯度。如果把金属离子脱离晶格而移向氧化膜所需要的能量记作W,将电子移向氧化物导带所需的能量记作Φ,按W<Φ和W>Φ两种情况来进行讨论。
(1)W<Φ的情况 当W<Φ时,金属离子在强电场的作用下移入氧化膜,此时电子的移动较困难,所以电子的移动成了反应速度的控制步骤。在这种情况下,表面氧化膜的生长取决于电子能否移入氧化膜中。如果电子脱出功Φ大于1eV,在常温下就不能发生热电子发射现象,因此就不能进行氧化。但是在极薄氧化膜的情况下,存在着量子力学的隧道效应,使电子能够移入氧化膜中,因此发生了膜的生长。隧道效应随膜厚的增加呈指数函数减小,当膜厚达到4nm时电子就不能通过了。因此膜的生长速度也是随着膜的厚度呈指数函数减小,直至最后停止。在这种情况下,膜的生长速度与电子因隧道效应而通过膜的几率成正比,如果以Y表示膜厚,其反应速度可表示为

式中,K为常数;h为普朗克常数,即6.626×10-34J·s;me为电子质量,即9.109×10-31kg;Φ为势垒高度。
将式(1-13)积分,得
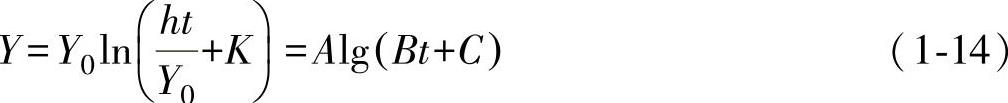
此时,Y和lgt呈线性关系,这就是对数规律,如Cu氧化为Cu2O、200℃以下Ni的氧化、225℃以下Zn的氧化等都属于这种情况。
(2)W>Φ的情况 当氧化膜再厚一些时,由于氧化膜对离子移动阻力的增加要大于对电子移动阻力的增加,因此当膜达到一定厚度时就变为W>Φ,离子的移动成了决定反应速度的控制步骤。所以即使是在通常认为离子不能移动、氧化不能发生的特定温度下,由于极薄膜上吸附氧后产生的强电场的影响,离子的移动还是可能发生的,也就是说氧化膜还是能够继续生长。在约107V/cm的强电场下,膜内的电位梯度为E时,离子电流iion的大小按下式指数函数关系变化:

式中,K为常数;Z为移动离子的电荷数,即离子价数;a为势垒的谷间距,可以在位能曲线上求得;e为电子电荷,即1.602×10-19C;k为玻尔兹曼常数,即1.381×10-23J/K。
由于氧化速度与iion成正比,E=V/Y,因此膜厚的生长速度可由下式表示:
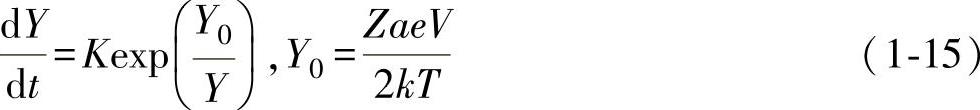
即在电场的影响下,膜的增厚速度按指数关系逐渐减慢,当膜达到一定厚度时,金属离子的扩散停止了,膜的生长也就完全停止。将式(1-15)积分可得下式:

1/Y与lgt成正比,这就是反对数规律。Cu、Fe、Al、Ag等在室温或稍高于室温时的氧化就属于这种情况,如图1-10所示,在2~3h内,膜迅速增加到一定厚度,随后氧化速度显著变小,以至几乎完全停止。

图1-10 在室温下,Cu、Fe、Al、Ag的氧化膜厚度随时间的变化
2.薄氧化膜的生长规律
按反对数规律,氧化膜停止生长的原因是膜厚的增加导致膜中电场强度的减小,致使离子的移动发生困难。但是如果升高温度,给予了离子移动所需的能量,则氧化反应又可以继续进行,氧化膜又会不断增厚。这时的电场作用力已经不足以推动离子移动,但给予了离子移动的方向。此时,离子电流的强度与电场强度之间已不再符合指数关系,也就是说在超过室温的较高温度下,氧化膜的生长规律已不再适用。这种情况出现在膜厚为10~300nm范围内的薄膜上,其生长规律因缺陷氧化物类型的不同而有所差异。
(1)金属过剩型氧化物 金属过剩型氧化物膜生长的控制步骤是间隙阳离子在膜内的移动,所以反应速度与晶格内间隙阳离子电流iion的大小成正比,而iion又与膜内的电场强度E和间隙阳离子的浓度nion成正比。在实际的氧化膜中,由于反应的迟缓以及离子移动的缓慢,使得金属-氧化物和氧化物-氧气的界面之间总是存在着表面电荷,如图1-10a所示。当表面膜较薄时,可以忽略膜内的空间电荷,因此可得到一个简化的双电层模型,如图1-11b所示。

图1-11 界面双电层
a)实际氧化膜中的界面双电层 b)简化的双电层模型
简化的双电层模型是一个电容器型的双电层,膜内的电位梯度是恒定的,膜内电场强度随膜厚的增加而按比例减小。根据这一假定,E与Y-1成正比,膜厚的Y的生长可表示为

积分后得抛物线规律:
Y2=Kt
式中,K为常数,它与厚膜理论求得的速度常数具有完全不同的意义。
实验已证明,400℃时Al的氧化、350~400℃时Zn的氧化都符合这种规律。
(2)金属不足型氧化物 具有金属不足型氧化物的金属发生氧化时,离子在膜中的浓度梯度和电场强度作用下的移动过程是氧化反应进行的控制步骤。与金属过剩型氧化物中的间隙阳离子是在金属-氧化物界面上的金属进入氧化物内而形成的情况不同,金属不足型氧化物的阳离子空位,则是在氧化物-氧气界面上,由氧化物与吸附氧离子O-之间反应而生成的。所以阳离子空位浓度n□与表面吸附的氧离子浓度 成正比
成正比

由于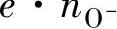 等于氧化物-氧气界面的表面电荷密度,所以电场强度E与
等于氧化物-氧气界面的表面电荷密度,所以电场强度E与 之间的
之间的
关系为

式中,ε为氧化物的介电常数。由于E随膜厚的增加而减小,所以膜中的缺陷浓度n□也应随膜厚Y的增加而成比例地减小,即E∝Y-1,n□∝Y-1,所以(https://www.chuimin.cn)

积分后,得到立方规律:
Y3=kt
实验中可观察到,350℃时Ta的氧化、216℃时Ti的氧化、400℃或475℃时Ni的氧化等都符合立方规律。
3.厚氧化膜的生长规律
氧化膜厚度在100nm以上时称为厚氧化膜。在温度升高时,金属离子向氧化膜中移动的趋势将增加,由于热电子发射,电子的移动也变得容易了。金属离子和电子在氧化膜中移动的结果,使晶格缺陷、准自由电子和正孔等在膜内得以均匀分布,导致氧化膜内各处都能保持电中性。此时膜层较厚,所以双电层的影响减弱。在这种情况下,粒子移动的推动力不再以电场的影响为主,而主要考虑浓度梯度。因此,氧化膜的生长规律取决于下列三个过程中以何者为控制步骤:
1)金属-氧化物的界面反应,反应阻力用WR1表示。
2)由于氧化膜中的浓度梯度而引起的离子扩散,扩散阻力用WD表示。
3)氧化物-氧气的界面反应,反应阻力用WR2表示。
氧化反应速度的一般式可以表示为

式中,ΔC为膜中氧气或金属的浓度梯度;WR1、WR2为相界面的反应阻力;WD为氧化膜内的扩散阻力。
温度对反应阻力WR的影响不大,所以即使在高温时也不能忽略。但温度对WD的影响很大,低温时扩散阻力很大,但随着温度的升高而迅速减小。所以在一定的厚度范围内,由于温度的不同,氧化反应的控制步骤既可能是扩散过程,也可能是界面反应,因而显现出不同的生长规律。
(1)抛物线规律 当膜内扩散阻力很大,相对来说相界面的反应阻力可以忽略时,由于扩散阻力与氧化膜厚度成正比,即WD=aY,所以式(1-16)可以简化为

在此,k/a为扩散系数。在通常情况下,扩散离子在膜两边的浓度,一边为饱和值,另一边接近于零,所以浓度梯度大致认为是一个恒定值,因此取kΔC/a=K,于是式(1-17)变换为

将式(1-18)积分,若当t=0时,Y=0,则得到:
Y2=2Kt
所以氧化膜的增长符合抛物线规律。Fe、Cu等大多数金属在生成厚而致密氧化膜的高温氧化过程中都符合抛物线规律。换句话说,当抛物线规律成立时,生成厚而致密的氧化膜,并且膜中的离子扩散是反应速度的控制因素。
(2)混合抛物线规律 当相界面的反应阻力WR不能忽略,并且不随时间而变化,在一定温度下有一定值时,即
WR1+WR2=b,WD=aY (1-19)
将式(1-19)代入式(1-16),可得

取kΔC=K,将式(1-20)积分,得
aY2+2bY=2Kt (1-21)
将式(1-21)变形,得

从式(1-22)中可以得出Y与t/Y呈直线关系。Fe、Cu、Ni等在低氧分压环境中氧化时,如Fe在水蒸气中的氧化,就属于这种情况。
(3)直线规律 若氧化膜内离子的扩散非常迅速,而界面反应速度却较慢时,界面反应就成为氧化反应速度的控制因素。此时,离子的扩散阻力忽略不计,即假设WD=0,则式(1-20)可改写为
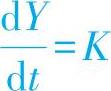
将上式积分,并假设t=0时,Y=0,则
Y=Kt
即界面反应控制的高温氧化反应中,膜的生长速度与原有的膜厚度无关,膜厚度随时间成正比地增加,称之为直线规律。
例如,900~1000℃下在CO-CO2气氛中Fe氧化为FeO的反应和Cu在1000℃的氧化反应等都符合直线规律。但是,如果Fe的氧化是在900℃以下进行时,由于氧化膜内的扩散阻力WD的增大,反应应符合抛物线规律。
上面介绍了金属氧化时的各种生长规律,任何一种金属放在室温下的大气中,最初均迅速地被氧化,在完全没有氧化物的金属表面上最初的氧化总是符合直线规律,但不久氧化速度急剧减慢。在电子移动成为速度控制步骤时符合对数规律;在离子移动成为速度控制步骤时符合反对数规律,所以在室温下生成的氧化膜厚度都不会超过一定的限度,一般为2~3nm的保护性氧化膜。大多数金属在室温或稍高于室温的情况下都具有这种性质。但在100℃以上的高温时,各种金属就显现出不同的规律。温度在100~500℃之间时,基本上都符合抛物线规律,但也有少数金属符合立方规律。当温度在1000℃或1000℃以上时,有的金属符合抛物线规律,也有的金属符合直线规律。在氧化反应过程中,膜内物质一般来说移动总是比较慢的,所以按抛物线规律进行氧化的情况最为普遍。表1-4列出了各类金属氧化膜厚度与时间关系的速度方程式。
表1-4 各类金属氧化膜厚度与时间关系的速度方程式

相关文章

铝合金成分的影响 铝合金的化学成分,不仅对膜层的耐蚀能力有影响,而且对膜层厚度,外观颜色影响较大。在相同情况下纯铝得到的氧化膜比合金的氧化膜厚、色泽好。硅铝合金较难氧化,膜层发暗。杂质的影响 杂质主要是Al3+和Cl-、F-、NO3-离子。1)Al3+离子的影响。适当的Al3+对氧化膜形成有好处,但含量不能过高,否则电阻太大。电解液浓度的变化对膜在电解过程中的溶解产生很大的影响。......
2025-09-29

在镁合金上制得的阳极氧化膜,其耐蚀性、耐磨性以及硬度一般都比用化学氧化法制得的要高,其缺点是膜层的脆性大,而且对于复杂的工件难以获得均匀的膜层。阳极氧化膜的结构及组成决定了膜层的性质,而不同的阳极氧化电解液及合金成分对于膜层的组成和结构又有很大的影响。膜层硬度 镁合金经阳极氧化处理后,随着膜层厚度的增长,其硬度明显下降,见表266。......
2025-09-29

观察结果证明,采用铬酸、磷酸、草酸和硫酸得到的阳极氧化膜结构完全相同。表219 不同氧化膜中细胞或孔隙数目图24所示为铝及铝合金阳极氧化膜的多孔蜂窝结构,在其膜层上,微孔垂直于表面,其结构单元的尺寸、孔径、壁厚和阻挡层厚等参数均可由电解液成分和工艺参数控制。铝阳极氧化膜硬度与其他材料的硬度比较见表220。......
2025-09-29

为讨论表面氧化物对锡须生长的影响,我们参考铝的小丘生长效应。图6.5表面没有氧化物时的应力弛豫现象为了将这些模型应用于没有氧化物的锡镀层上,由于存在应力梯度,因此每个晶粒都会通过向各自的自由表面扩散而发生弛豫现象,如图6.5所示。相比于锡铜镀层的晶粒尺度而言,晶须的直径为几微米。似乎最容易破坏氧化物的地方在晶须的根部。而氧化物破损后暴露出来的自由表面为晶须生长提供了应力梯度。......
2025-09-29

晶须的生长是一种独特的蠕变现象,在该过程中,应力的产生与释放同时发生。所以,通过由晶界自扩散机制引起的原子重新排列,其由化学反应在锡中产生的压应力在室温下也可被释放。因此在施加载荷的端面和其侧面之间就存在着一个应力梯度。但是,一个均匀的压应力场是不会造成蠕变现象的。因此,我们需要一个在锡镀层内产生压应力梯度的机制。因此,在氧化物破损模型中便可建立起应力梯度,蠕变或晶须生长也会随之发生。......
2025-09-29

由系统的传递函数框图可得EPC系统的开环传递函数为式中 k——开环放大系数,。将算得的ωh、ξh、k代入式,可据此画出EPC系统的开环伯德图。图12-18 改造前后CP机组EPC系统的开环伯德图由图12-18可得系统的性能指标为:①穿越频率:ωc=2.4Hz;②幅值裕量:h=16dB;③相位裕度:γ=75°。可见实测值和理论分析值比较接近,说明上面建立的EPC系统的数学模型和确定的参数是正确的,是可以作为预测改造后系统性能的依据的。......
2025-09-29

因此,凡是加氧或脱氢的反应称为氧化反应,而加氢或脱氧的反应则称为还原反应。表3-1氧化还原法分类在选择处理药剂和方法时.应当遵循下面的一些原则:处理效果好,反应产物无毒无害,不需进行二次处理。与生物氧化法相比,化学氧化还原法需较高的运行费用。因此,目前化学氧化还原法仅用于饮用水治理,特种工业用水处理,有毒工业废水处理以及以回用为目的的废水深度处理等有限场合。......
2025-09-29
相关推荐