与玻璃型护栏的护壁板垂直水平面布置结构类似,直型金属护栏的护壁板也是呈垂直布置状态的区别在于两者的材质不同。因此,在正常情况下,金属材质护壁板相对于玻璃材质护壁板安全性更高。该护栏结构与直型金属护栏在结构组成上除了护壁板的倾斜角度和没有内盖板的区别之外,并无大的区别。......
2025-09-29
化学腐蚀的速度取决于表面氧化膜的性质,特别是膜的电子导电性和离子导电性。金属氧化物本身并不具备导电性,但带有缺陷的氧化物就具有了导电性。
金属氧化物属于离子型晶体,当它非常完整时,是优良的绝缘体,此时离子的移动很困难,金属的进一步氧化受到阻碍。但实际上,金属氧化物的离子晶体中总是存在着晶格缺陷,它使氧化反应进行所需要的离子或电子的传递成为可能,从而使金属表面的氧化物薄膜能够不断地生长。离子或电子的传递构成了导电性,所以氧化物的电导率大体上决定了它的生长速率。
根据氧化物的缺陷和导电情况,可把氧化物薄膜分为离子导体和半导体两大类。
1.离子导体
由于物质是不断运动的,只要晶体的温度高于绝对零度,晶体中的原子就会不断运动,并与周围原子之间的相互作用达到平衡。随着温度的升高,离子运动的动能也相应增加,如果晶格结点上的离子获得了比平均动能更大的能量时,能越过势垒从晶格结点跃出,进入到其他晶格的间隙成为晶格间隙离子。在原来的位置上则留下一个空位,称为离子空位。这种缺陷是由于热运动而产生的点缺陷,称为热缺陷。热缺陷是个熵增过程,因此从理想晶体到缺陷晶体是自发过程。
具有化学计量比缺陷,并且导电物质是间隙离子或离子空位的金属氧化物质晶体称为离子导体。离子导体又可分为阳离子导体、阴离子导体和混合离子导体。
(1)阳离子导体 由于阳离子的跃迁而形成等量的间隙阳离子和阳离子空位的热缺陷称为正Frenkel缺陷。间隙阳离子和阳离子空位都能发生移动,故称为阳离子导体,如MgO、CaO、HgO等。我们以MgO为例,图1-7a所示的是MgO的理想晶格结构,图1-7b所示的是具有正Frenkel缺陷的MgO晶格结构。
MgO的这种缺陷方程式可以用下式来表示:

式中,○和□分别表示间隙离子和离子空位。
(2)阴离子导体 由于阴离子的跃迁而形成等量的间隙阴离子和阴离子空位的热缺陷称为反Frenkel缺陷。间隙阴离子和阴离子空位都能发生移动,故称为阴离子导体,如Al2O3、Sb2O5、La2O3等。对于金属氧化物晶体,阴离子就是O2-。其缺陷方程式为

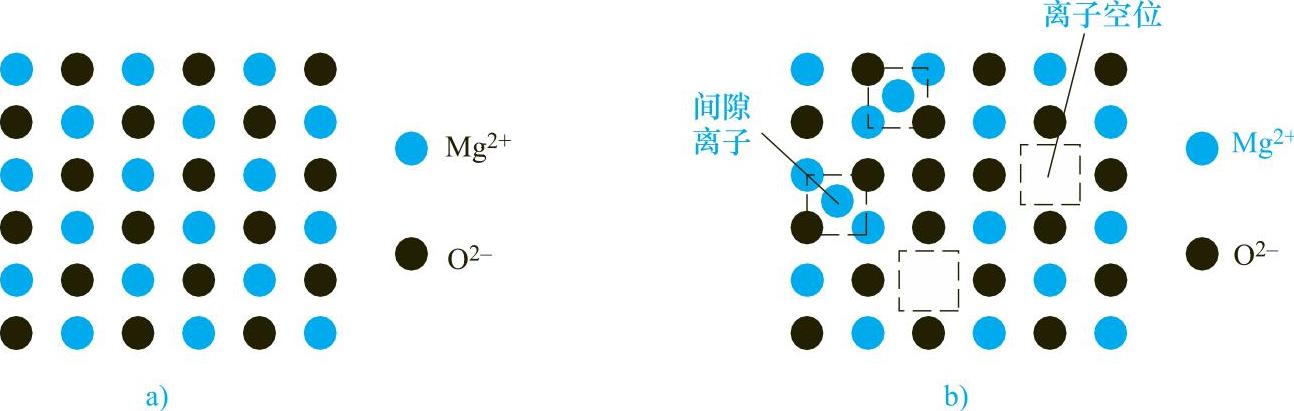
图1-7 MgO的晶格示意图
a)MgO的理想晶格结构 b)具有正Frenkel缺陷的MgO晶格结构
(3)混合离子导体 金属氧化物晶体中的阳离子或阴离子由于热运动获得了足够的能量,从原来的位置迁移到晶体表面,在原来的位置上留下不被其他离子占据的空位。这个空位可以随着热运动逐步扩散到晶体内部,造成内部的空位,这种缺陷称为Schottky缺陷。具有Schottky缺陷的金属氧化物都是混合离子导体。
在形成Frenkel缺陷时,离子挤入晶格间隙位置所需的能量要比仅产生Schottky空位所需的能量大,因此在温度不太高时,Schottky缺陷的数目要比Frenkel缺陷数目大得多。
2.半导体
离子导体的导电过程是通过离子的迁移来完成的,由于离子扩散速度慢,因而电导率低,对氧化反应的阻碍作用也大。但在具有非化学计量比晶格缺陷的晶体中,因含有准自由电子或电子空穴,其电导率大大增加,成为半导体,对氧化反应的阻碍作用也大为减小。
我们在精确测量金属氧化物的元素组成时,常常发现与其严格的化学计量比组成之间存在微小的差异,即在晶格中存在着少量过剩的金属离子或氧阴离子,因此形成了各种形式的晶体缺陷,这种缺陷可以称为非化学计量比缺陷。这类缺陷即使不存在热振动,也包含在原有的晶格之中。表1-3列出了几种常见的非化学计量比缺陷金属氧化物的元素组成。
(1)金属过剩型半导体 金属过剩型氧化物可以有两种存在形式。第一种形式是过剩的金属离子位于晶格的间隙位置,为了保持晶体的电中性,必须同时存在与间隙金属离子数目相等的准自由电子(用☉表示);或者是间隙阳离子得到电子而变成中性的间隙原子。第二种形式是晶格点阵上缺少阴离子,为了保持电中性,它可以是晶格阳离子得到与阴离子空位所携带的相等电量的电子变成中性原子;也可以是在晶格间隙或在阴离子空位上存在相同电量的准自由电子。
表1-3 常见的非化学计量比缺陷金属氧化物的元素组成
上述两种过剩金属存在的形式就构成了四种缺陷形式:①间隙阳离子—准自由电子;②间隙金属原子;③阴离子空位—晶格中的金属原子;④阴离子空位—准自由电子。其中第一种是主要缺陷形式,如ZnO、CdO、BeO、BaO、V2O5、Ta2O5、PbO2、MoO3、WO3、SnO、SnO2、TiO2等晶格中都存在着间隙阳离子和准自由电子。图1-8所示的是ZnO晶体中的离子排布示意图。
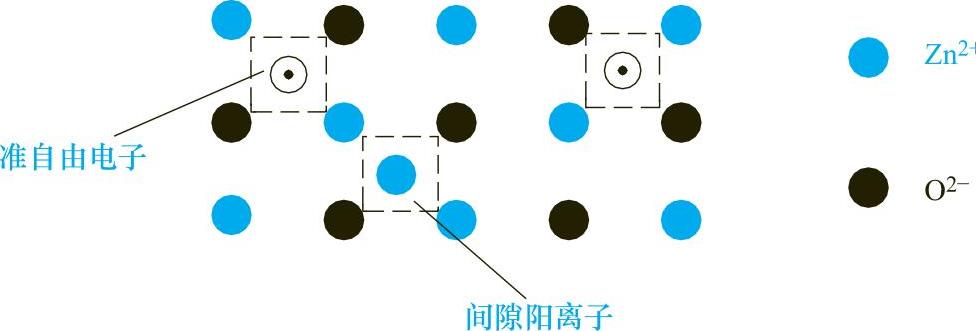
图1-8 ZnO晶体中的离子排布示意图
金属Zn在空气中氧化生成带有晶格缺陷的ZnO时,可用下述方程式表示:

晶体中的间隙离子Zn2+和准自由电子移动到晶体表面上与氧结合而形成新的ZnO晶格。
由于缺陷的浓度极低,因此式(1-1)可以看作是一个基元反应,可以应用质量作用定律,即反应的速率与反应物的质量浓度成正比:

式中,v为方程式(1-1)的反应速率;k为反应速率常数;[ ]为质量浓度。
根据电中性条件可知

将式(1-3)代入式(1-2),可得

变换式(1-4),可得

当处于平衡状态时,氧化锌薄膜以恒定的速度增长,因此v等于定值,那么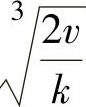 也为一个常数,我们可用K来表示,即
也为一个常数,我们可用K来表示,即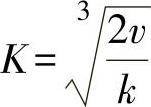 ,代入式(1-5)得到
,代入式(1-5)得到

式(1-6)说明氧化锌薄膜中的准自由电子浓度与气相中氧的分压的-1/6次幂成正比。
我们知道,金属过剩型半导体中主要起导电作用的是准自由电子,也就是说该半导体的电导率σ与准自由电子浓度[☉]成正比,所以
 (https://www.chuimin.cn)
(https://www.chuimin.cn)
但在实际测量600℃下的ZnO的电导率σ时,却发现:
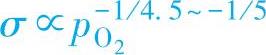
造成两者不一致的原因是间隙锌离子并不是全部以二价离子的形式存在,也可以有一价的锌离子存在,即上述缺陷方程式也可依下式进行:

同样运用质量作用定律可得到该反应的速率为

式中,v′和k′分别表示式(1-7)的反应速率和反应速率常数。
因为
[○Zn+]=[☉]
所以
v′=k′[☉]2pO1/22 (1-9)
变换式(1-9)可得到
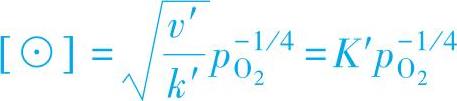
当氧化膜处于稳定生长阶段时,可以将v′看作是常数,那么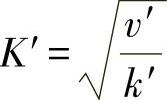 也可以看作是一个常数,于是
也可以看作是一个常数,于是

由此可知,ZnO中的间隙离子同时存在着Zn+和Zn2+两种状态,因此实测的σ会介于两个理论值之间。这类氧化物的导电性主要是靠准自由电子,因此属于N型导体。
从上面的理论计算结果,可以推测出带有ZnO表面膜的Zn氧化时的机理是:
1)在金属-氧化膜界面上,由于Zn→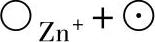 或Zn→
或Zn→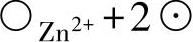 ,Zn从金属基体转移到氧化膜中,形成间隙离子和准自由电子。
,Zn从金属基体转移到氧化膜中,形成间隙离子和准自由电子。
2)在ZnO膜内,间隙离子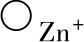 、
、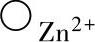 和准自由电子☉由于在浓度梯度的推动下,从金属侧向气体侧扩散移动。3)在氧-氧化膜界面上,由于发生
和准自由电子☉由于在浓度梯度的推动下,从金属侧向气体侧扩散移动。3)在氧-氧化膜界面上,由于发生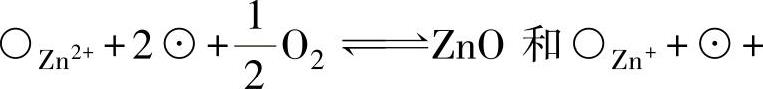
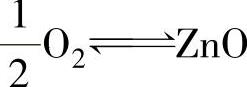 的反应,生成了ZnO,从而使ZnO膜不断生长。
的反应,生成了ZnO,从而使ZnO膜不断生长。
(2)金属不足型半导体 含有过剩阴离子的氧化物是金属不足型半导体,过量的阴离子可处于间隙位置,或者在晶格点阵上存在阳离子空位。因此金属不足型半导体存在三种缺陷形式:①间隙阴离子—电子空穴;②阳离子空位—部分阴离子失去电子而成的中性原子;③阳离子空位—电子空穴。为了保持晶体的电中性,与过量阴离子相当数量的一部分阳离子会转变为高价阳离子,即缺电子的部位,称为电子空穴或正孔,用⊕表示。由于氧离子很大,很难挤进晶格中形成间隙阴离子,所以很多氧化物都具有第三种缺陷形式,如Cu2O、NiO、CoO、FeO、Bi2O3等。
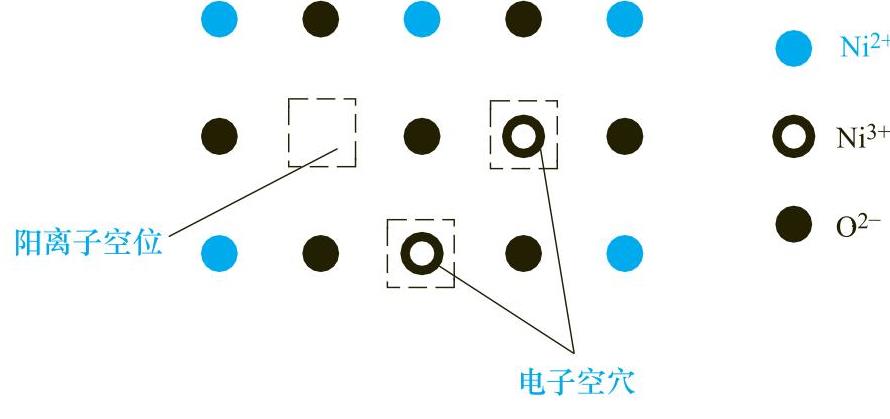
图1-9 NiO中的离子排布示意图
图1-9所示的是NiO中的离子排布示意图。在理想的NiO晶体中,Ni2+与O2-离子在空间有规律地相间排列在各自的晶格结点上,一个Ni2+对应于一个O2-。但当NiO中存在一个阳离子空位时,为了保持晶体的电中性,必有两个Ni3+与之相对应,于是在这两个结点上与正常的晶格结点相比少了一个电子,因此又称为电子空穴。
当有NiO膜的Ni继续氧化时,其缺陷方程式为

当表面生成氧化物时,NiO膜中会新生Ni2+离子空位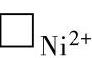 和电子空穴⊕。所以随着氧化反应的进行,晶体内电子空穴的浓度会增大,因而电导率也会增大,这称为氧化性半导体。该半导体的电导率主要取决于电子空穴的浓度,所以又称为P型半导体。但从本质上讲,电子空穴的导电过程仍然是电子的传递过程
和电子空穴⊕。所以随着氧化反应的进行,晶体内电子空穴的浓度会增大,因而电导率也会增大,这称为氧化性半导体。该半导体的电导率主要取决于电子空穴的浓度,所以又称为P型半导体。但从本质上讲,电子空穴的导电过程仍然是电子的传递过程

与前面所述的N型半导体中准自由电子导电的区别在于P型半导体的电子只是在高价阳离子与低价阳离子之间传递,它并不能脱离阳离子而单独存在。
根据质量作用定律,反应式(1-10)的反应速率可表示为

根据电中性原理,可得

将式(1-12)代入式(1-11),并变换可得

当处于平衡状态时,氧化速度保持恒定,因此,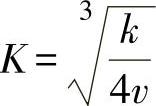 为一常数。因为电导率σ取决于氧化膜中的电子空穴的浓度,所以
为一常数。因为电导率σ取决于氧化膜中的电子空穴的浓度,所以

Ni上的NiO表面膜生长过程中,在膜内的氧分压是从氧侧向金属侧逐渐减小。由于 和[⊕]随氧分压的增大而增大,所以它们的浓度是从氧侧向金属侧逐渐减小。因此,
和[⊕]随氧分压的增大而增大,所以它们的浓度是从氧侧向金属侧逐渐减小。因此, 和[⊕]是从氧侧向金属侧方向扩散。
和[⊕]是从氧侧向金属侧方向扩散。
从上述的分析中,可以推测出Ni的氧化膜的生长机制应该是:
1)在氧-氧化膜界面上,由于反应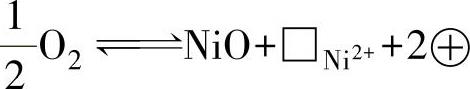 ,生成NiO的同时也形成了
,生成NiO的同时也形成了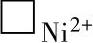 和⊕。
和⊕。
2)在氧化膜内,生成的 和⊕向氧化膜-金属界面扩散。
和⊕向氧化膜-金属界面扩散。
3)在氧化膜-金属界面上,电子空穴⊕具有很强的氧化能力,可以夺取Ni原子中的电子形成Ni2+,新生的Ni2+则进入到阳离子空位上,即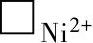 +2⊕+Ni→Ni2+,
+2⊕+Ni→Ni2+,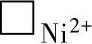 和⊕在金属Ni转变为Ni2+并移入氧化膜后被消灭。
和⊕在金属Ni转变为Ni2+并移入氧化膜后被消灭。
相关文章

与玻璃型护栏的护壁板垂直水平面布置结构类似,直型金属护栏的护壁板也是呈垂直布置状态的区别在于两者的材质不同。因此,在正常情况下,金属材质护壁板相对于玻璃材质护壁板安全性更高。该护栏结构与直型金属护栏在结构组成上除了护壁板的倾斜角度和没有内盖板的区别之外,并无大的区别。......
2025-09-29

但是,由于液压马达和液压泵的工作条件不同,对它们的性能要求也不一样,所以同类型的液压马达和液压泵之间仍存在许多差别。液压马达按其结构类型不同可以分为齿轮式、叶片式、柱塞式和其他形式,按液压马达的额定转速可分为高速和低速两大类。低速液压马达的基本形式是径向柱塞式,其主要特点是排量大,转速低,因此可直接与工作机构连接,不需要减速装置,使传动机构大为简化。......
2025-09-29

金属氧化生成的氧化物薄膜的性质取决于氧化物薄膜分子的体积与生成此氧化物薄膜所消耗的金属体积之比,这个比值又称为Piling-Bedworth比,常用φ表示。一般认为要生成致密的氧化物薄膜,φ应该在1.2~2.0之间,此时生成的氧化物薄膜体积膨胀不大,又受到微小的压应力,能较好地阻止金属与氧的进一步接触。除此之外,金属氧化物薄膜能否有效地保护金属基体,还取决于该金属氧化物薄膜的物理性质以及与金属的结合力。......
2025-09-29

按照成形工艺的不同,铜及其合金可分为铸造铜合金和变形铜合金两大类。只含锌的铜锌二元合金称为普通黄铜,是航空领域应用最为广泛的结构铜合金。表4-1 铸造铜合金牌号及化学成分注:1.布氏硬度试验力的单位为牛顿。铍青铜是wBe≈2%的铜合金,具有高的强度、硬度、弹性、耐磨性、耐寒性和抗应力松弛性,用于制造航空仪器仪表,还可用于......
2025-09-29

驱动主机按结构形式可分为立式主机和卧式主机两种。图3-2-2是一种采用蜗轮蜗杆传动的立式主机,多用在普通型扶梯上,在早期的公交型扶梯上也有使用。其特点是电动机和减速箱都是卧式的,具有传动相对平稳的优点,但占有空间相对较大。曾经有制造厂尝试使用一台主机同时驱动一台上行和一台下行的并列布置的扶梯,以达到节省能耗的目的。但是GB 16899—2011中明确规定,不允许使用一台主机同时驱动两台自动扶梯,以确保扶梯的安全性。......
2025-09-29

金属材料常分为黑色金属 和有色金属 。正因为钢的热处理是在不改变金属材料牌号的前提下,使之得以强化,充分发挥材料的内部潜力,故是提高机械产品质量,降低成本的一种重要手段。回火温度在150 ~250℃,主要用来降低材料的脆性和淬火应力,并能保持较高的硬度和耐磨性,常用于刀具、模具等。回火温度在350 ~500℃,其特点是既能保持材料一定的韧性,又能保持一定的弹性和屈服点,常用于弹簧和承受冲击的零件。......
2025-09-29

按电梯用途分类是一种常用的分类方法,但由于电梯有一定的通用性,所以按用途分类用得较多。(一)乘客电梯乘客电梯以运送乘客为主,兼以运送重量和体积合适的日用物件。其派生品种有住宅电梯、观光电梯等。其结构比乘客电梯坚固,装饰要求较低。此外特种电梯还包括:冷库电梯、防爆电梯、矿井电梯、电站电梯、消防员用电梯立体车库(电梯)等。......
2025-09-29
相关推荐