各种铸造镁合金均需进行精炼处理。表3-49 镁合金精炼处理工艺3.变质处理用熔剂Mg-Al-Zn系镁合金变质处理原理 变质处理的目的是为了改善镁合金的结晶形态,使结晶组织细化,从而提高其力学性能。表3-52 镁合金熔铸中使用熔剂的实例(续)(续)......
2023-06-26
镁的化学活性很强,在空气中易氧化,在原镁生产、合金熔炼及合金化过程中易产生大量的夹杂物并带入大量的气体,熔炼镁合金时常采用专门的熔剂对镁液进行精炼,去除镁液中的气体、氧化夹杂以及一些有害合金元素。镁合金熔剂的主要成分是碱金属或碱土金属的氯化物及氟化物的混合物。
1.对除夹杂物熔剂性能的要求
(1)熔点
应低于金属液的熔点,这样可使熔剂在整个合金熔炼过程中保持液体状态,在金属熔炼过程中形成完整严密的覆盖层或精炼时能很好地吸附合金液中的夹杂物及易于从金属液中分离。
(2)密度
熔剂和金属液应有较大的密度差,即熔剂的密度或者大于金属液的密度或者小于金属液的密度,以防止熔剂混杂在金属液中成为熔剂夹杂。
(3)粘度
从覆盖的角度看,要求熔剂的粘度小些,以便在金属液面上容易铺开;从浇注操作角度分析则要求熔剂的粘度大些,便于将熔剂和金属液分开。
(4)造渣性
熔剂本身不应带有对金属液质量有害的杂质及夹杂物,对于精炼熔剂来说,应有强的俘获金属液中气体夹杂并迅速沉降的能力。
(5)化学稳定性
熔剂不与镁合金、坩埚壁、炉衬及炉气发生化学反应,熔剂本身不挥发,不分解。
(6)无公害
熔剂本身对人体无毒,不会燃烧,便于运输贮存,使用中产生的有害气体要少,残渣便于处理。
2.熔剂的主要组元
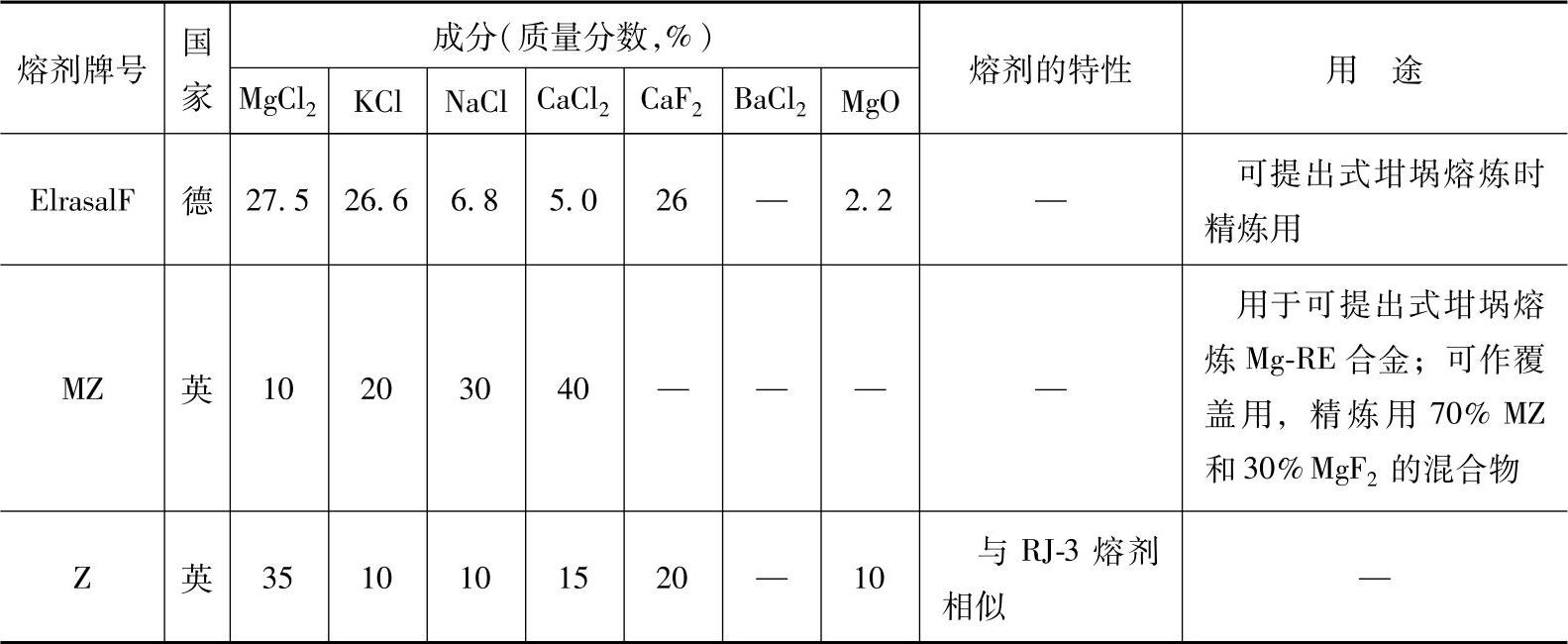
目前国内常使用的熔剂是商品化的RJ系列熔剂,见表2-5,国外镁合金熔剂的成分、性能及用途见表2-21。熔剂的主要组分均为氯盐和氟盐,各主要组成物在熔剂中的作用如下:
(1)MgCl2
通常是含有6个结晶水的MgCl6·6H2O,加热时会失去2个结晶水,成为MgCl2·4H2O。这时MgCl2发生水解生成MgO及HCl,所以MgCl2的脱水应在特殊的装置中进行。MgCl2是镁合金熔剂的基本组元,高温下MgCl2以部分与大气中O2及H2O等反应,而在镁液表面形成HCl及H2的保护气氛,阻缓了镁液的氧化。液态MgCl2对镁液中的MgO、Mg3N2等夹杂物具有良好的润湿能力,并能与MgO形成MgCl2·5MgO复合化合物,因而具有较强的去除氧化夹杂的能力。
(2)KCl
熔剂的基本组元。由于KCl表面张力、粘度均较小,它的存在显著降低表面张力和粘度。KCl能降低熔剂的表面张力和粘度,改善熔剂的铺开性能,使熔剂能均匀覆盖在镁液体表面。
表2-21 国外镁合金熔剂的成分、性能及用途

(续)
(3)NaCl
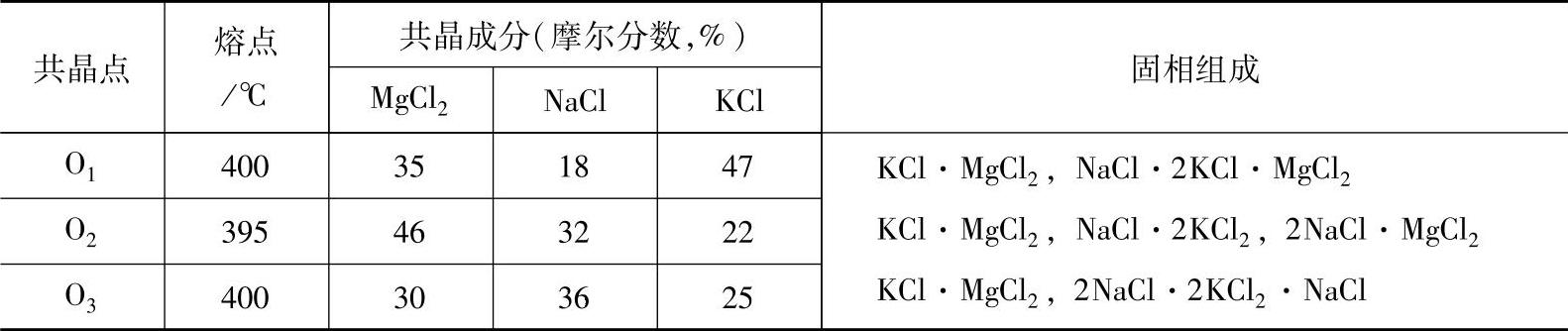
熔剂的基本组元。NaCl与MgCl2、KCl构成MgCl2-KCl-NaCl三元系。它的存在使熔剂的密度增加,并可用来调整熔点。如图2-18所示为MgCl-KCl-NaCl三元系溶度图,这个体系中有三个共晶点、七个初晶区,其共晶点、共晶成分和固相组成见表2-22。从溶度图可以看出,该体系中有一系列状态点,其初晶温度均低于镁合金的熔点,这样在镁合金熔化时,能有效地起到保护作用,所以选择MgCl2、NaCl、KCl作为覆盖剂、精炼剂的基本组元。
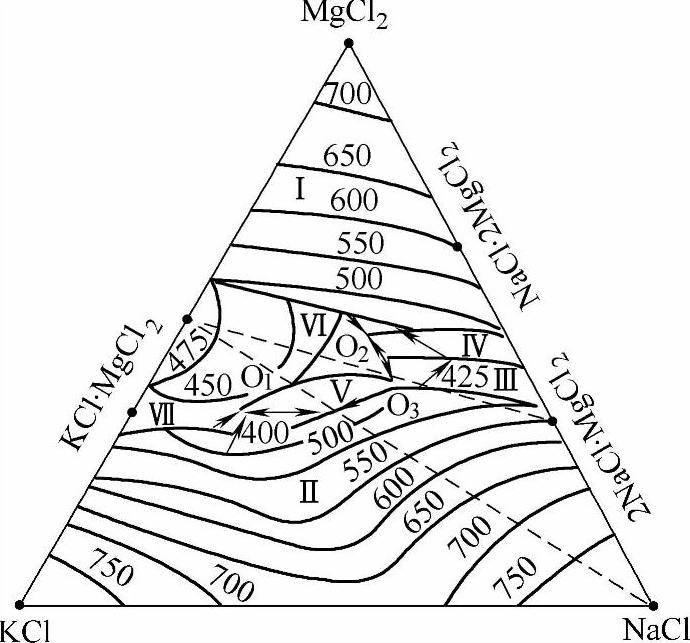
图2-18 MgCl2-KCl-NaCl三元系溶度图
(4)CaF2
可提高熔剂的粘度和精炼性能。CaF2在MgCl2-KCl-NaCl三元系中有一定的溶解度,超过此溶解度时,液态的混合盐中出现未溶解的Ca初质点,大大提高混合盐的粘度。另外,CaF2+MgCl2=MgF2+CaCl2生成的MgF2在氯盐中溶解度很小,且其溶解度不随温度变化,MgF2还有与MgO化合而造渣的能力。CaF2提高熔渣与镁液的分离性能,具有良好的聚渣作用,覆盖剂中加入CaF2可以很方便地去除表面熔渣。
表2-22 MgCl2-KCl-NaCl三元系的共晶点、共晶成分和固相组成
(5)MgO
用作熔剂的“稠化剂”,提高熔剂的粘度。
(6)BaCl2
BaCl2具有较大的密度,室温下为3.87g/cm3,作为“加重剂”加入。BaCl2主要提高熔剂的密度,使熔剂与镁液分离,提高精炼效果。但是,对于覆盖用的保护熔剂,BaCl2的加入是无益的。加入BaCl2后熔剂的密度和熔点都迅速提高,当熔剂密度超过镁的密度时,熔剂会沉于镁液之中,降低熔剂的保护性能。
(7)发泡剂
特殊的无机化合物,加入覆盖剂中,在镁合金熔炼温度下,持续地释放出对镁液具有保护作用的气体,使覆盖剂成泡沫状,不易下沉,减少了覆盖剂的使用量,同时释放出的保护气体稀释了HCl等有害气体,显著减少了使用过程中有害气体的排放,达到无公害的目的。当这种发泡剂加入精炼剂时,它使精炼剂发泡,极大地增大了比表面积,从而提高了熔剂吸附氧化夹杂的能力。另外,它所释放出的气体又对镁液进行物理除气,因而强化了熔剂的精炼能力。
3.熔剂的物理化学性质
熔剂的物理化学性质随许多因素的变化而变化,如温度、熔盐组分、杂质、添加剂量等。一些常见熔剂主要组成物的物理化学性质见表2-23。
表2-23 一些常见熔剂主要组成物的物理化学性质
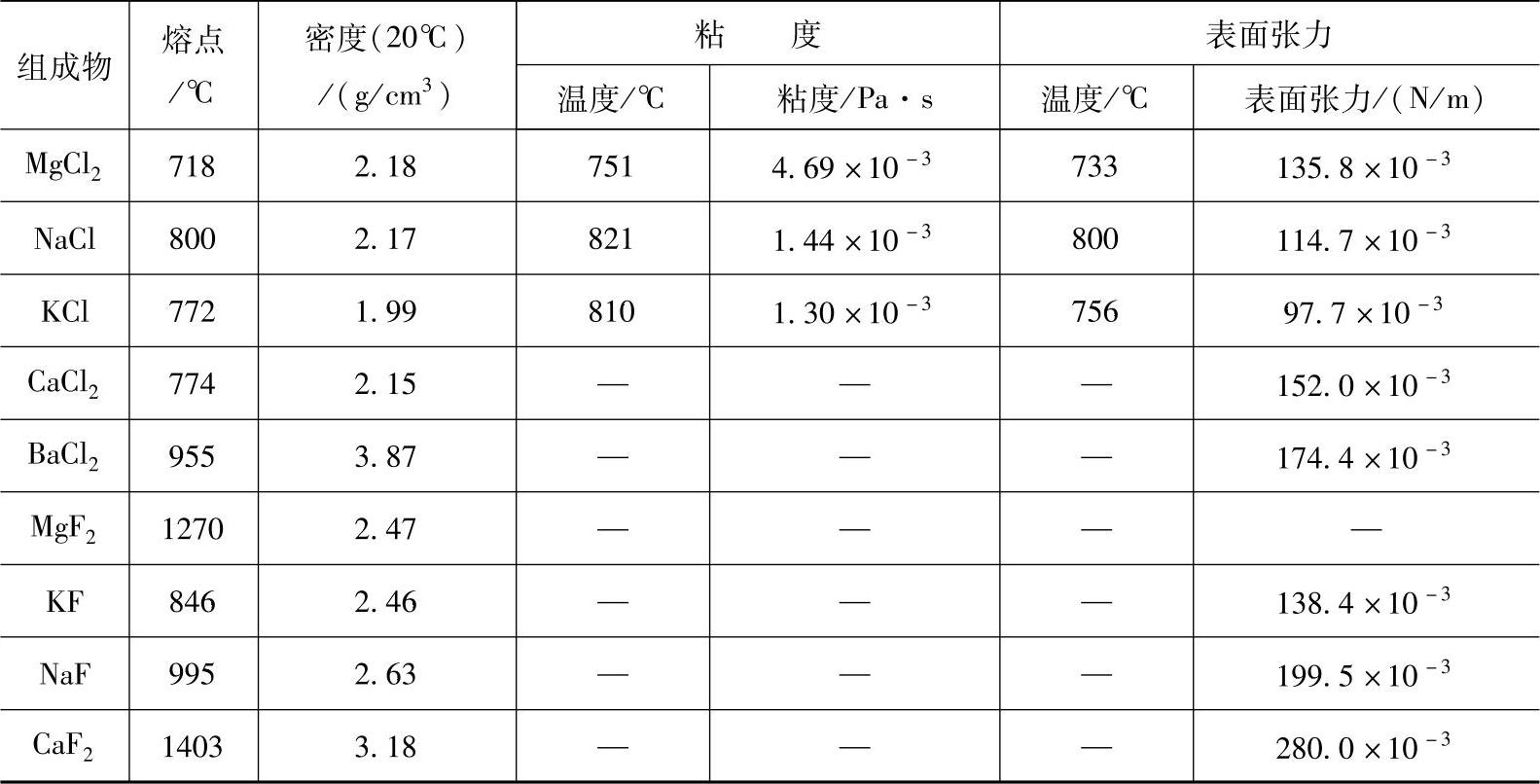
表2-23中的数值表明,氯化物的熔点与表面张力小于氟化盐。BaCl2在氯化盐中有较大的密度,KCl的粘度和表面张力都较小。
对于熔盐的精炼性,是指氯化物的湿润吸附性,从浸渍氧化镁实验和被氧化镁吸收含量来看,其湿润性顺序为KCl>NaCl>MgCl2>CaCl2>BaCl2。文献资料表明MgCl2能有选择地和MgO发生化学吸附,因此从熔剂单体的物理化学性质来看,精炼剂的主体系应由MgCl2-KCl或MgCl2-KCl-NaCl组成,MgCl2-KCl或MgCl2-KCl-NaCl混合熔盐体系的物理化学性质,能满足精炼熔剂的条件。为改变精炼各过程中的物理化学性质,BaCl2是较好的加重剂,氟化盐是较好的非表面活性物质,添加于熔剂中,用以改善熔渣与镁液的分离性和增大熔剂表面张力是不可缺少的。
在精炼过程中通常还添加CaF2。CaF2在氯化盐熔体中的行为可归纳为以下几种情况:
1)CaF2在氯化盐熔体温度下(800℃),大部分以悬浮态存在,溶解度很小。
2)添加CaF2能较大地提高氯化盐熔体和镁液间的界面张力,1%~2%(质量分数)的CaF2能使熔体界面张力提高5%~8%。
3)添加CaF2能使熔体密度和粘度增加1%~5%,密度和粘度的变化值按添加量呈线性增加,但总的影响较小。
4)添加CaF2能增强熔体对氧化物杂质的吸附湿润性,改善镁的汇聚,并能和部分氧化物发生化学反应。
4.杂质的去除机理
镁熔体中的非金属杂质有MgO、CaO、SiO2、Mg3N2、2CaO·SO2、Al2O3等,Mg3N2置放在空气中吸水,很快变成Mg(OH)2,Mg(OH)2在熔体中也以MgO形式存在。金属杂质K、Na、Fe、Zn、Mn、Cu、Al、Ni等部分以合金形式存在于镁中,它们对熔体的物理化学性质影响小,因此引起物理化学性质发生变化的主要是非金属氧化物杂质,其行为归纳如下:
1)大部分氧化物能被KCl、NaCl润湿,部分氧化物(MgO和CaO)能和MgCl2形成稳定或不稳定的配合物
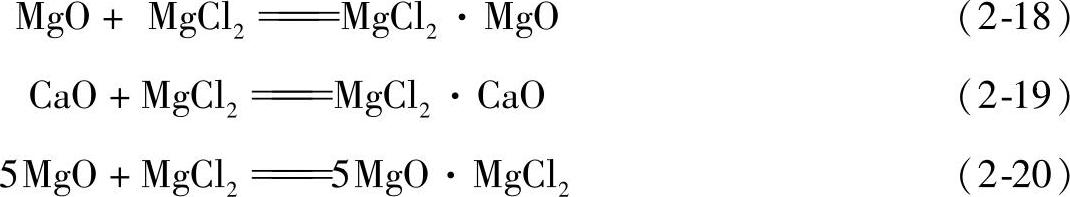
如果熔剂中含有氟化物会降低熔剂和夹杂之间的界面张力,也就是降低了自由能变化,从而可以提高净化效果。
2)杂质的溶入随着熔盐的汇聚和沉积,都能使熔盐的密度增大,凝固点提高,粘度变大。
3)大部分氧化物杂质被熔盐浸渍后,在熔体中表现为表面活性物质,降低熔盐的表面张力。
4)氧化物都能使镁和熔剂的分散体系稳定,不利于镁的汇聚。
由此可见,氧化物杂质能被熔盐体系通过物理或化学吸附而去除,对于金属杂质K、Na来说,一般都能在熔体中发生下列置换反应而被除去:
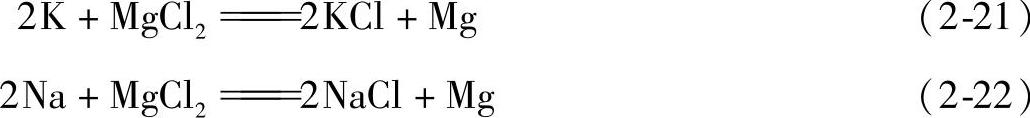
有关有色金属熔炼入门与精通的文章

各种铸造镁合金均需进行精炼处理。表3-49 镁合金精炼处理工艺3.变质处理用熔剂Mg-Al-Zn系镁合金变质处理原理 变质处理的目的是为了改善镁合金的结晶形态,使结晶组织细化,从而提高其力学性能。表3-52 镁合金熔铸中使用熔剂的实例(续)(续)......
2023-06-26

表3-18 熔制法配制熔剂的工艺参数熔炼工艺是先将KCl、NaCl按上表规定的配料比例准确称取后装入炉内升温熔化。出炉温度应控制在850℃以下,控制每炉熔剂的熔制时间不得超过6h。NaCl+KCl+CaF2(4.4)+Na2AlF6(6.6)铝合金用熔剂的配制工艺1)按配比称取各组元,放入干净的容器内。......
2023-06-26

对熔剂的技术要求如下:1.熔剂的熔化温度熔剂的熔化温度应低于金属或合金的熔化温度,以便能在金属液表面形成一层均匀而连续的液体保护层,但其熔点不能比金属或合金的熔点低得太多,以防熔剂在熔化温度下变得很稀而不能起保护作用。......
2023-06-26

捷联式惯性导航系统没有物理伺服平台。 初始对准是指惯性系统进入导航工作状态之前, 确定每个加速度计输入轴的方向或者捷联矩阵的初始值。 当前状态计算是指惯性系统进入导航工作状态, 根据加速度计和陀螺仪输出, 按照力学方程组, 实时解算并提供载体的速度、位置和姿态角等导航参数信息。随着航海、航空、航天技术的不断发展, 人们对惯性导航系统工作精度要求越来越高。......
2023-06-15

智能化的深度是指智能制造中基于智能化进行决策的程度,主要有辅助决策、简单决策和复杂决策三类。而青山公司则基于拉式生产方式开展厂内生产物料精准管理。智能信息还可以在机床、网络、个人或集体之间共享,方便进行智能协同并作出更好的决策。大量的智能设备就会组合成整套的智能系统。智能系统包括网络优化、维修优化、系统恢复、系统学习等多种形式。......
2023-06-23

要达到上述对熔剂的技术要求,首先就要对配制熔剂用的各种原材料的成分、纯度及相关的物理、化学性能提出严格要求,并经过检测试用,确认合格后才能使用。4)材料的化学性能要稳定,保证不变质。2)材料在配成熔剂使用时,应有利于防氧化阻燃,而不引发燃烧甚至爆炸等危害。......
2023-06-26

要按国务院“十二五”的产业发展政策和国家的环保及劳动保护政策,严格审批新办熔剂厂,经环保部门严格检查,确认合格后,主管部门才核发生产许可证。除此之外,还要不定期检查环境和劳动保护的执行情况,发现问题,限期整改。2)在熔剂生产中,凡接触这些有害、有毒性的熔剂,要注意穿戴防护用具。......
2023-06-26

吹气法过去主要应用于铝合金除氢,现将其应用于镁合金净化。它不仅有除气作用,还兼有变质效果,其细化晶粒效果优于MgCO3。添加变质剂于高温镁液,分解后生成的CO2也有一定除气作用。有人提出,向镁合金中加入0.1%~0.2%的Ca,有一定的除气效果,因为Ca与H2能形成稳定的CaH2化合物。有关镁合金的含气量检测,以及含气量对缩孔、缩松及力学性能的影响详见2.6.2节。图2-19 温度及氢含量对ZM5合金除气速度的影响图2-19 温度及氢含量对ZM5合金除气速度的影响......
2023-06-22
相关推荐