铝液中最常见的夹杂物是氧化物。夹杂物测定中最大的问题是夹杂物的扩散问题。图1-66中为熔体夹杂真空过滤检测系统,由过滤器、过滤杯、锥形塞和真空容器几部分组成。图1-67 加压过滤测定法示意图特征:用显微镜观察,虽然手续繁琐,但由于能够评定夹杂物的种类及数量,多用于要求高清洁度的型材合金液的评价。......
2023-06-22
精炼的目的是去除铝液中的气体(氢气)及夹杂物,提高纯净度。
如式(1-14)所述,溶入铝液的氢浓度与溶液表面上的氢分压服从亨利定律:

式中 [%H]——铝液中氢的浓度;
pH2——液面炉气中的氢分压。
由上式可以看出,铝液温度下降或者减小炉气中的氢分压pH2都会降低合金液中的氢浓度。因此,采用真空处理,即降低铝液表面的氢分压,或者往铝液中吹入惰性气体(见图1-29),即可在铝液内部形成许多氢分压为零或氢分压较低的气泡,直至气泡中氢的分压pH2上升,与铝液中氢的浓度符合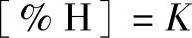
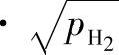 达到平衡关系为止,在这个过程中惰性气泡带着氢逸入大气。这就是目前国内外熔铝精炼采用的主要方法。
达到平衡关系为止,在这个过程中惰性气泡带着氢逸入大气。这就是目前国内外熔铝精炼采用的主要方法。
铝液中的氢向外来的初始无氢气泡迁移的动力学过程可分解为以下五个步骤:
1)通过对流和扩散,氢原子迁移到铝液与气泡的气-液界面。
2)氢原子由溶解状态转变为吸附状态。
3)气-液界面吸附的氢原子彼此相互作用缔结为氢分子,即2H→H2。
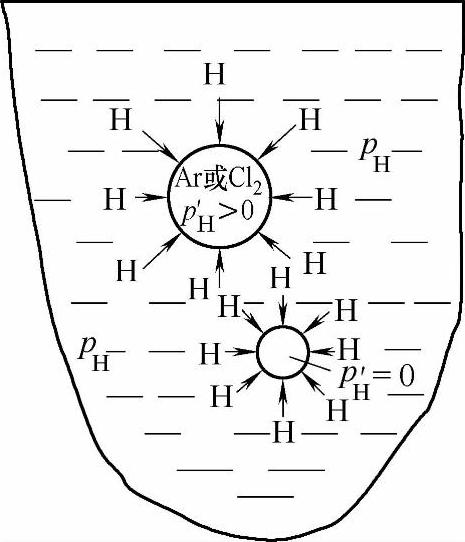
图1-29 铝液中的氢向惰性气泡或活性气泡中迁移示意图
4)氢分子从气-液界面脱附。
5)氢分子扩散进入气相,并随气泡上浮逸出铝液。
一般认为,铝液的除氢速度被氢在铝液中的扩散速度所限制。高温时,表面化学反应的速度很快,上述步骤2)、3)、4)不大会成为速度的限制性环节。高温时(特别是真空条件下),气相中的分子扩散速度很快,步骤5)也不会成为速度的限制性环节。根据列恩斯特(Nernst)的边界层理论,由于两相界面分子相互吸引及流体本身具有一定的粘度,使得任意两相接触面都存在边界层,因此较多的学者认为,除氢速度由氢在铝液中的扩散边界层的扩散速度所控制。
氢在边界层的扩散过程是一种传质过程,它不能简单地用扩散定律加以描述。这是因为,冶金熔体中存在着流动现象,流体中的传质,除了分子扩散外,还有流体的对流传质,称为对流体扩散。按照列恩斯特的边界层理论,氢气在熔炼中的脱气速度为

对于大多数试验来说,界面上的浓度Cms可视为常数,经积分得到脱气动力学方程为

式中 Cm——反应时间t时铝液内部的氢浓度;
Cmo——铝液内部的原始氢浓度;
Cms——气液界面处的氢浓度;
A——反应界面积;
V——熔体体积;
k——传质系数,与流体的物理性质、扩散系数D、相界面形状等有关;
t——反应时间。
如果忽略界面处气相边界层扩散阻力,那么Cms可从氢在气相的分压力和化学平衡数据求出。对于真空熔炼条件,Cms→0,Cms<<Cm<<Cmo,上式可简化为

式(1-25)就是铝液边界层扩散为限制性环节的除氢速度公式。
由式(1-25)可以看出:减少精炼气泡直径(A/V与气泡直径成反比),延长喷气精炼时间(即增加气泡与铝液接触时间t),加强搅拌,可能提高除气精炼效果。
目前,国内外应用最广泛的方法是旋转喷头吹气净化方法,如图1-30、图1-31所示。气体熔剂由轴心孔道或轴与套管间的间隙引入,被旋转叶轮打碎成微细气泡,在旋转与上浮双重作用下气泡呈螺旋形曲线轨迹缓慢上升,因而产生极高的除氢效果。
有关有色金属熔炼入门与精通的文章

铝液中最常见的夹杂物是氧化物。夹杂物测定中最大的问题是夹杂物的扩散问题。图1-66中为熔体夹杂真空过滤检测系统,由过滤器、过滤杯、锥形塞和真空容器几部分组成。图1-67 加压过滤测定法示意图特征:用显微镜观察,虽然手续繁琐,但由于能够评定夹杂物的种类及数量,多用于要求高清洁度的型材合金液的评价。......
2023-06-22

除气精炼就是去除溶解在铜液中的气体,而这些气体又主要是铜液吸氢带来的,所以除气主要就是除氢。以通氮气除气为例,当O的体积分数为0.5%时,除气效果降低40%。吹氮除气一般在熔炼后期、出炉前进行,吹氮时应保持熔池液面微微波动,避免出现铜液飞溅的现象。为提高除气精炼效果,应控制气体的纯度,精炼气体中O的体积分数一般低于0.03%,水分低于3g/L。......
2023-06-22

固体渗碳剂主要由一定大小的固体炭粒和起催渗作用的碳酸盐组成。常用固体渗碳温度为900~930℃。图5-17固体渗碳工件装箱示意扩散速度与温度的关系表现为温度越高,扩散速度越快。液体渗碳工件在渗碳冷却或淬火后,应清除盐渍,以防止表面腐蚀。液体渗碳速度和工件表面碳含量取决于盐浴温度及盐浴的活性。液体渗碳速度较快,如20CrMnTi在920~940℃渗碳时,保温2~3h,渗层深度可达到1.0~1.5mm。......
2023-06-24

吹脱汽提法的基本原理是气液相平衡和传质速度理论。传质速度取决于组分平衡分压和气相分压的差值。汽提法处理水时,可认为溶质在气相中的浓度与在水中的浓度比为一常数,遵循分配定律,即式中:、——气液平衡时,溶质在蒸汽冷凝液中及水中的浓度,g/L;k——分配系数。可见,k值越大,越适于用汽提法脱除。......
2023-06-19

弹簧3的弹簧力较小,用于在比例电磁铁输出推力为零时克服摩擦力,确保阀芯关闭。与输入电信号成比例的电磁力与阀座孔口处的轴向液压力相平衡。压力反馈先导式比例减压阀级间动压反馈原理和前述溢流阀的相同。如本章4.2节所述,传统先导式压力阀的先导阀控制的是主阀上腔压力,先导阀所受弹簧力和主阀上腔的压力相平衡。控制特性一般有占总调节范围20%左右的零位死区,这是所有单向调节电液比例阀的共同特点。......
2023-06-15

爱因斯坦欢呼一声,他获得了一生中令他最快乐的想法,那就是加速度和引力在物理效果上是相同的,这被爱因斯坦称为等效原理。电梯刚刚启动上升时,你会觉得自己的心一沉,好像身体变重了;电梯快停下来时,你又会觉得自己的心一飘,好像身体变轻了有了等效原理,爱因斯坦终于能把万有引力放到自己的理论中了。因为万有引力通过等效原理就和加速度关联上了,而加速度和运动是关联的。......
2023-11-05

神经系统的反应能力、做动作的频率和动作幅度的大小,是影响速度素质发展的主要因素。速度素质是人体的基本身体素质之一,在身体训练中占有重要地位。在不同的运动项目中,速度素质均具有重要作用。良好的速度素质有助于练习者更好地掌握运动技巧。速度素质的意义主要体现在以下三个方面:第一,速度素质是决定运动成绩的重要因素。......
2023-11-21

在合金液除气精炼之后、浇注之前,应检测铝液的含气量;若精炼后保温时间较长,铝液的吸气量增多,也应在一段时间后检测含气量,以确定金属液是否可浇注或再进行精炼除气。分析表明,铝合金或镁合金液中的气体90%左右是氢气,因此检图1-59 金属型试样浇注系统结构及尺寸测含气量主要就是检测氢含量。......
2023-06-22
相关推荐