若在镁液中添加少量的Be可以提高镁熔体的抗氧化能力。这是因为Be是镁的表面活性元素,富集于镁熔体表面,致使熔体表面含Be量为合金的10倍,并优先氧化。BeO的致密度系数α=1.7l,故BeO充填于氧化膜孔隙中形成致密的复合氧化膜。氮还能与镁合金中的元素反应,生成氮化物,形成非金属夹渣,影响金属的纯度,直接影响合金的耐蚀性和组织上的稳定性。实验研究表明,在700℃下采用密封坩埚熔炼镁合金,CO2的防护性尚好。......
2023-06-22
熔炼的目的是获得高质量的铝液供铸造零件或连铸使用,主要应满足下列要求:
1)化学成分符合国家标准或企业标准,合金液成分均匀。
2)合金液纯净,氧化夹杂、气体、熔剂夹杂含量低。
3)对于需要变质处理的合金液,变质效果良好。
铝是一种化学活性很强的金属,比铁和铜的化学活性强。铝液很容易和空气中的氧、水蒸气和炉气中的氧化性组分起作用,也容易和熔炼工具(首先是坩埚)起反应,使铝液产生氧化、吸气及携带夹杂物,从而使铸件产生气孔及夹杂等缺陷。
铝合金的熔炼过程主要是一个炉料的重熔及化学成分调整的过程,熔炼的内容涉及配料计算、炉料处理、熔炼设备选用、工具处理及熔炼工艺过程控制等。
1.铝液的氧化
(1)铝及合金元素的氧化
铝合金通常在大气中熔炼,当铝液和大气或炉气中的O2、N2、H2O、CO2、CO、H2、CmHn等接触时,会产生化合、化分、溶解、扩散等过程。
高温下,液态的铝遇氧会发生下述反应:

炉气或空气中的水蒸气也会与铝液发生反应使铝液氧化,生成Al2O3,并生成氢原子进入铝液:

在铝液表面生成一层致密的γ-Al2O3氧化膜,可阻止铝液进一步氧化。Al2O3的熔点达2050℃,不溶解于铝液,而且很难被其他元素所还原。在操作过程中,如破坏了此氧化膜,新鲜合金液就被露出,一方面使合金液吸气和再次被氧化,另一方面又使氧化膜的碎片(其密度与铝液的密度接近,比表向积大——即颗粒小,在合金液中处于上升或下沉的悬浮状态,很难排出)和熔渣卷入合金液中成为夹杂物,这些夹杂物不但显著地降低合金的性能,而且还成为吸附气体形成气泡的核心。
铝液中的其他合金元素,如Si、Mg等元素,也容易被氧化。用Me代表合金元素,其氧化反应可用下面的通式:
(2m/n)Me+O2(2/n)MemOn (1-3)
按常用合金元素与氧的亲和力的大小,可从大到小依次排列如下:
Be→Li→Mg→Na→Ca→Al→Ce→Ti→Si→Mn→Cr→Zn→Fe→Ni→Cu
按此次序,可以知道它们与Al反应生成氧化物的稳定性情况。共中Al以后的与氧亲和力比Al小的元素,在铝液中为非表面活性元素,形成复杂的氧化物,其组织致密,对铝液起屏蔽保护作用,与Al2O3氧化膜一起可防止铝液的再氧化和吸气,所以Al-Si系、Al-Cu系、Al-Zn系合金可以不加覆盖剂在大气中熔化。但在Al之前与氧的亲和力比Al大的元素,如Be、Mg、Na、Ca等元素,则在铝液中是表面活性元素,它们与高温的炉气接触时,在Al之前先被氧化,所形成的氧化膜组织疏松,对铝液无屏蔽保护作用。所以,Al-Mg系合金就需要在覆盖剂保护下,才能在大气中熔炼。只有Be的氧化膜是例外,它可充填MgO氧化膜的疏松间隙,使其致密,起保护铝液的作用。这些氧化膜都属于不溶于合金液的一类。
(2)合金液氧化的影响因素
1)炉气和空气的影响。在前文已提及,空气和炉气中的O2、H2O、CO2是使铝液氧化的根源。除反应式(1-1)和(1-2)的反应外,炉气中的氧化性成分还可能发生以下反应:


其他易氧化元素,如Ca、Li等也容易发生上述的类似反应。
上述反应都是铝合金与气体接触时进行的,接触的表面积越大,反应时温度越高,则反应越活泼,氧化量也越大。而合金料块和回炉铝屑越薄小,表面积越大,其氧化量就越大。搅动熔池也会增加上述接触面积,加大氧化量。
水蒸气对铝液的氧化比O的作用小一些,还可抑制CO2对Al-Mg合金的氧化。
为了减少这些气体与合金液的接触机会和接触面积,减缓氧化速度,降低氧化量,可在合金液表面加入SiF4、BF3、SF6等氟化物或含氟气体,因它们吸附在氧化膜的表面,其气体有遮挡屏蔽上述氧化性气体进入熔池或降低其迁移速度的作用。
2)熔化温度与时间的影响。熔炼温度的高低对合金液的氧化速度起主要作用。铝或铝合金在大气中熔炼时,氧化膜的厚度随温度和持续时间的不同,在0.1~10μm范围内变化。例如,对于ZL101等亚共晶Al-Si合金来说,在铝液温度高于780℃时,氧化量会显著增加。
熔化、保温、浇注时间的长短对铝合金的氧化也有较大的影响。熔化、浇注温度越高,熔化到浇注的时间越长,则铝合金的氧化也越厉害,特别是对Al-Mg系合金尤为明显。所以,为了尽量减少合金液的氧化,应尽量控制好熔化、保温、浇注这三个温度,尽可能防止过高温度的过热,尽量缩短从装炉到熔化到浇注过程的时间。
3)合金元素的影响。合金元素对铝液的氧化有较大的影响。主要合金化元素Cu、Si、Mg及其含量多少的影响各不相同。随着Cu含量的增加,合金的氧化量减少,Si也能使铝合金的氧化量减少,wSi为4%,其氧含量减少量最大,这是由于Cu和Si都能使氧化膜致密稳定。而wSi超过4%,则又使合金液的氧化量增加,这是因为此时生成了SiO2。
铝液中Mg含量的增加,对合金的氧化影响很大,因为Mg与氧的亲和力大于Al,Mg在Al之前被先氧化,首先生成MgO[式(1-5)]。然后生成尖晶石MgAl2O4:
2MgO+4Al+3O2=2MgAl2O4 (1-8)
因此,Al-Mg系合金熔化时,随着氧化量的增加,所形成的氧化膜是粒状的,因而也是疏松的MgO+MgAl2O4皮膜,对合金液不起屏蔽保护作用,H2、O2、H2O、CO2等气体可以继续进入铝液,使合金液进一步氧化并消耗掉有效元素Mg。实验结果表明,不管三元还是多元铝合金,只要其中添加了Mg,Mg就会首先被氧化。但假如其中还添加了与O亲和力比Mg大的元素,如Li、Be、Na等,则Mg的氧化在它们之后。
铝液的氧化,除了与上述三个因素有关外,还与O2(空气中的)的压力、氧化物的分解压、合金成分及含量、组元的扩散速度及氧化物本身的相互作用等因素有关。
2.铝液的吸气
(1)合金液中气体的来源
铝液中的气体成分的分析表明氢占85%以上,因而铝合金的“含气量”可以近似地视为“含氢量”。铝合金中的气体并不来源于炉气组成中的氢。根据气体分析,大气中氢的分压极微(约5Pa),远比铝液中的氢分压低,从热力学来看氢在铝液中是不稳定的。研究指出,分子态的氢不能溶入铝液中,只有离解成原子态才能进入铝液内。有人在纯净的氢气氛下熔炼合金,结果获得了没有气孔组织致密的合金锭。可见,炉气中的氢分子不是形成气孔的前提。科学研究证明:铝液中的氢和氧化夹杂物主要来自铝液和水蒸气的反应。气体的主要来源如下:
1)空气中的水蒸气。高温铝液与空气中的水蒸气接触时,发生如下反应:

式(1-9)和式(1-10)两式合并为

水蒸气与铝液反应生成的氢气在铝液表面离解为原子氢,进入铝液中,而Al2O3成为夹杂物。
可由相对原子质量求得式(1-11)中各成分的质量关系为
2×27kg+3×18kg→1×102kg+6×1kg
假设所产生的氢为标准状态下的分子氢,则将氢换算成体积为
18kg+18kg→34kg+22.4dm3化简后得
1g+1g→1.9g+1.244cm3
上式表明,1g铝与1g水(或水蒸气)发生反应,将生成1.9gAl2O3和1.244cm3的标准状态下的氢气。这说明,即使是极其微量的水或水蒸气,对于铝合金铸造来说,也是不容忽视的产生气孔缺陷的根源。
此外,铝液与水蒸气的反应也异常激烈。按热力学理论计算,在一般熔炼条件下(例如T=1000K),炉气中水蒸气分压pH2O=0.003MPa,这相当于我国南方及沿海夏季大气中的湿度。根据化学反应式计算表明,在反应界面即铝液表面上的氢分压pH2可能高达1.20×1010MPa,产生溶入铝液中的巨大驱动力,因而氢剧烈地溶于铝液中,如果操作工具和炉料潮湿则有发生爆炸的危险。
2)炉气中的水蒸气。若是普通的电炉或感应电炉熔炼,电炉周围的气氛主要是空气,如上所述,空气中含有水蒸气。
但是,现在很多的铝合金熔铸车间采用反射炉、快速熔化炉、坩埚炉等熔炉,燃烧天然气、重柴油、柴油、煤油、液化天然气、高炉煤气、焦炭等燃料,这些燃料的燃烧气体中,存在着大量的水蒸气和氢气,比起电阻坩埚炉来,导致产生的吸气量多得多。使用焦炭和高炉煤气作燃料时,虽然其含氢量比较少,但也会使合金的含气量达到0.15cm3/100gAl以上,而使用液化天然气和液化石油气等气体燃料时,铝液含气量更高。
3)炉料带入的水蒸气或油污。当温度低于250℃时,固体铝锭容易与水蒸气发生以下反应:

生成的Al(OH)3在铝锭表面,组织疏松,呈粉末状,对铝锭没有保护作用,俗称铝锈。
若用带有铝锈的铝锭作炉料,升温大于400℃时发生铝锈分解反应,反应式如下:
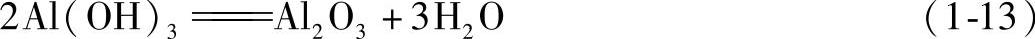
生成的水蒸气产生式(1-11)所示的反应。此外,分解产物Al2O3组织疏松,能吸附水蒸气和氢,混入铝液中,也增大气体和氧化夹杂的含量,使铝液质量变坏。因此,铝锭不宜储存在潮湿的库房内或露天存放,以防止生产铝锈。对有锈的铝锭,投入熔炉前应彻底清除铝锈,否则即使熔炉工艺操作很严格,也不易获得高质量的铝液。
此外,未经充分干燥的炉料、精炼剂、覆盖剂、变质剂中的水分;未经充分干燥的炉衬、坩埚和工具上的涂料所含的水分;残留在坩埚、工具和炉料上的含水熔剂等,都是水蒸气的来源。
在铸造工厂常使用粘附有切削油、切削液的切屑、浇冒系统、附有印刷油墨或附有乙烯树脂塑料等的饮料罐或附有油脂的食品罐等铝或铝合金用品、制品。涂料、油脂和非金属有机物均为碳氢化合物,在熔化时都会反应生成氢气,分子氢离解成原子氢而被铝液所吸收。这也是铝液吸氢的原因之一,故生产中应严格禁止将沾有油污的炉料直接投入熔池中,事先必须进行碱洗等处理,清除油污。
(2)氢在铝中的溶解度
在温度不变时,所有双原子的气体溶入铝液时都服从式(1-14):

式中 [wH]——溶于铝中氢的质量分数(%);
pH2——氢分压(MPa);
KS——温度不变时的参数。
如果气体浓度不服从这个公式,说明气体和铝相互作用,形成化合物。
工程应用中常使用溶解度方程式的对数式,用符号CH代表[wH]。式(1-15)即为有名的Sieverts公式:
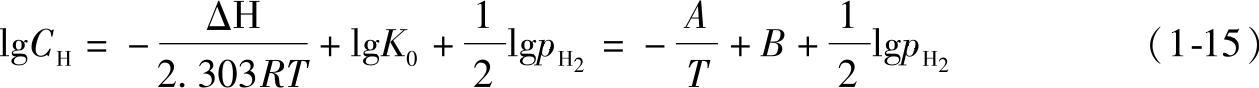
式中 ΔH——氢的溶解热(J/mol);
R——气体常数[J/(mol·K)];
T——热力学温度(K);
K0——常数;
A、B——与合金的化学成分有关的常数。可根据不同温度时的溶解度,采用线性
回归方法,求得A、B值后,即可求得溶解热ΔH和常数K0。
国际上公认的铝中氢的溶解度公式是用超纯铝(99.998%)在真空条件下通过实验获得的。氢在660~850℃铝液中的溶解度公式如下:
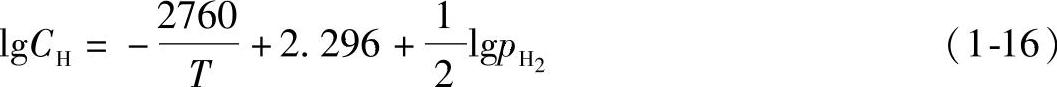
氢在固态铝中的溶解度公式如下:

式中 CH——氢的溶解度(cm3/100g)。
图1-14所示为几种金属中氢的溶解度变化曲线,由图1-14可知,在铝的熔点温度,从液态转变为固态时,氢的溶解度剧烈下降,在液态铝中的溶解度达0.68cm3/100g左右,而固态铝中只有0.036cm3/100g左右,两者之比为18.8,两者相差达0.64cm3/100g左右,相当于1.73%的铝液体积。
(3)铝液H含量的影响因素
1)铝液温度及氢气分压的影响。氢在铝液中的扩散速度可用原子扩散系数D表示。扩散系数与温度及压力的关系如下:
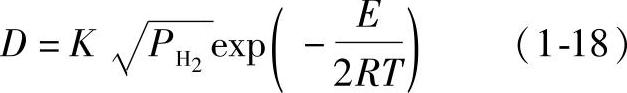
式中 E——扩散热(J/mol);
R——气体常数,8.3145J/(mol·K);
T——铝液温度(K);
pH2——氢分压(MPa);
K——常数。
由式(1-18)可见,氢分压pH2和铝合金熔体温度越高,扩散系数就越大,吸氢的速度就越大。
铝液中的合金元素及氧化夹杂物对氢的扩散速度有很大影响,通常会降低氢的扩散速度。
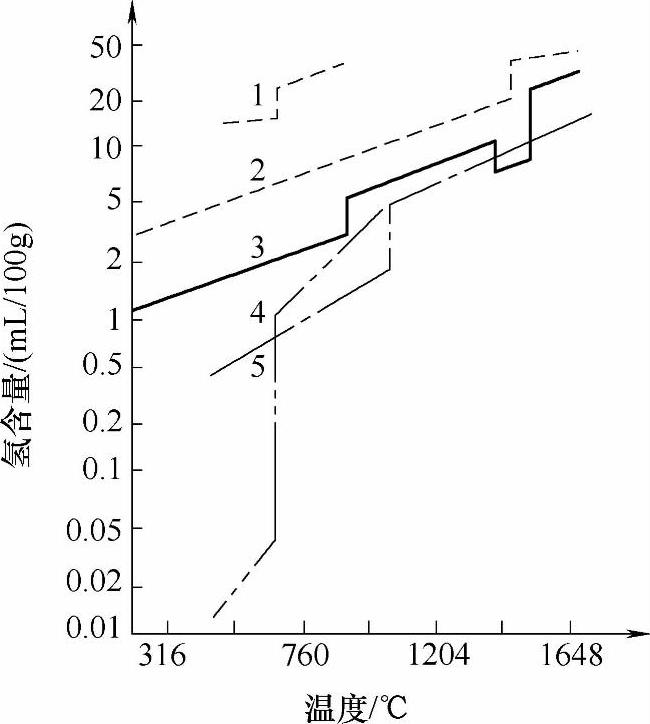
图1-14 几种金属中氢的溶解度变化曲线
1—氢在镁中 2—氢在镍中 3—氢在铁中 4—氢在铝中 5—氢在铜中
2)氧化铝的形态及性能对吸氢的影响。在室温下生成的表面氧化膜由少量结晶形态的γ-Al2O3和非晶态的Al2O3混合物所组成。根据结构分析,铝及其合金中存在着三种不同形态的无水氧化铝:γ、η和α,它们各自的特性见表1-6。随着温度的上升,非晶态Al2O3逐渐转化为η-Al2O3和γ-Al2O3,到铝熔点附近温度,氧化膜厚度达0.2mm,具有较高的强度,Rm≥20MPa。随静置时间的延长,η-Al2O3将逐渐全部转化为γ-Al2O3,在铝液表面形成一层致密的氧化膜,隔绝了炉气和铝液的直接接触,阻滞了铝液的氧化和吸气,能对铝液起保护作用。因此,除Al-Mg类合金外,铝合金可直接在大气中熔炼,不必加覆盖剂,这是γ-Al2O3膜有利的一面。
通过观察分析,氧化膜只有和铝液接触的一面是致密的,和炉气接触的一面却是粗糙、疏松的,存在着大量的直径为5×10-3mm的小孔,小孔中吸附着水蒸气和氢,甚至将γ-Al2O3焙烧到890~900℃,仍能吸附少量水蒸气,只有当温度高于900℃时,γ-Al2O3完全转化为α-Al2O3,才能较完全地脱水。熔炼时搅动铝液,划破连续、均匀地覆盖在铝液表面的氧化膜并卷入铝液中,铝液便和氧化膜小孔中的水蒸气反应,使铝液进一步氧化,生成氧化夹杂,吸入氢气。这样,γ-Al2O3膜就起了传递水蒸气的作用,成为氢和氧化夹杂的载体,这就是γ-Al2O3膜的不利的一面。
表1-6 不同形态氧化铝的特性
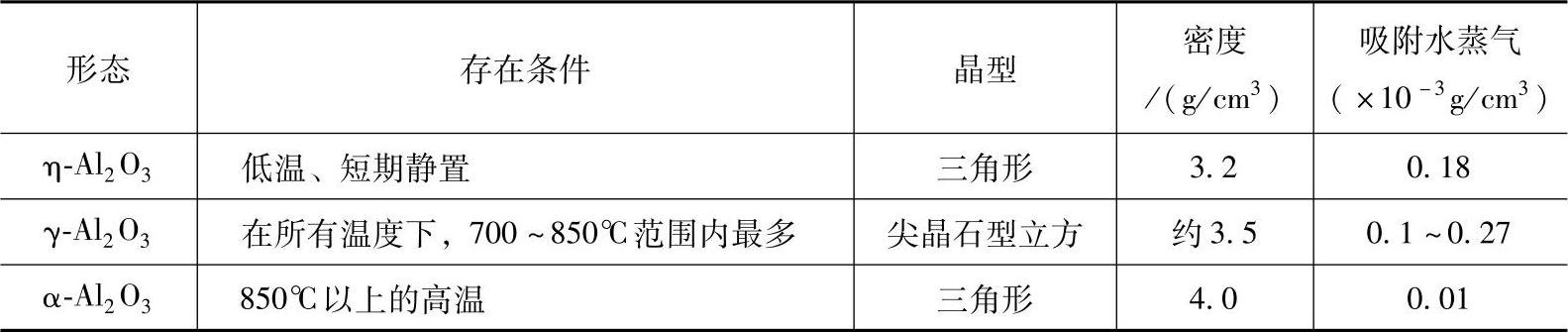
在600~700℃范围内η-Al2O3、γ-Al2O3吸附水蒸气和氢的能力最强,因此,铝液中的氢有两种存在形式:溶解氢和吸附在氧化夹杂缝隙中的氢,前者占90%以上,后者占10%以下。因此铝液中氧化夹杂越多,则氢含量也越高。通常,熔池深处氧化夹杂浓度较高,含氢量也较高。可见铝液中的Al2O3和H2之间存在着密切的孪生关系。
一种观点认为Al2O3吸附H2属于化学吸附,在Al2O3夹杂的周围存在着吸附力场,在吸附力场中氢的吸附方向和扩散脱氢方向相反,因而降低了扩散脱氢的速度。当Al2O3含量足够多,各个吸附力场相互靠拢时,进一步降低扩散脱氢速度,使除氢发生困难。这种观点能解释“渣多气多”、“渣多难除气”现象。
在铝液中卷入Al2O3夹杂增加了H含量,吸附H2的Al2O3又是温度下降时气泡形核的现成基底,容易在铸件中形成气孔。
有人对不同Al2O3夹杂量的铝液凝固后形成的针孔率进行了回归分析,证实Al2O3夹杂量与针孔率之间存在着正的线性相关性,即夹杂量增加,针孔率也随之增加,且wAl2O3低于0.001%后,铝液中不再生成气泡,形成针孔。
3)合金元素的影响
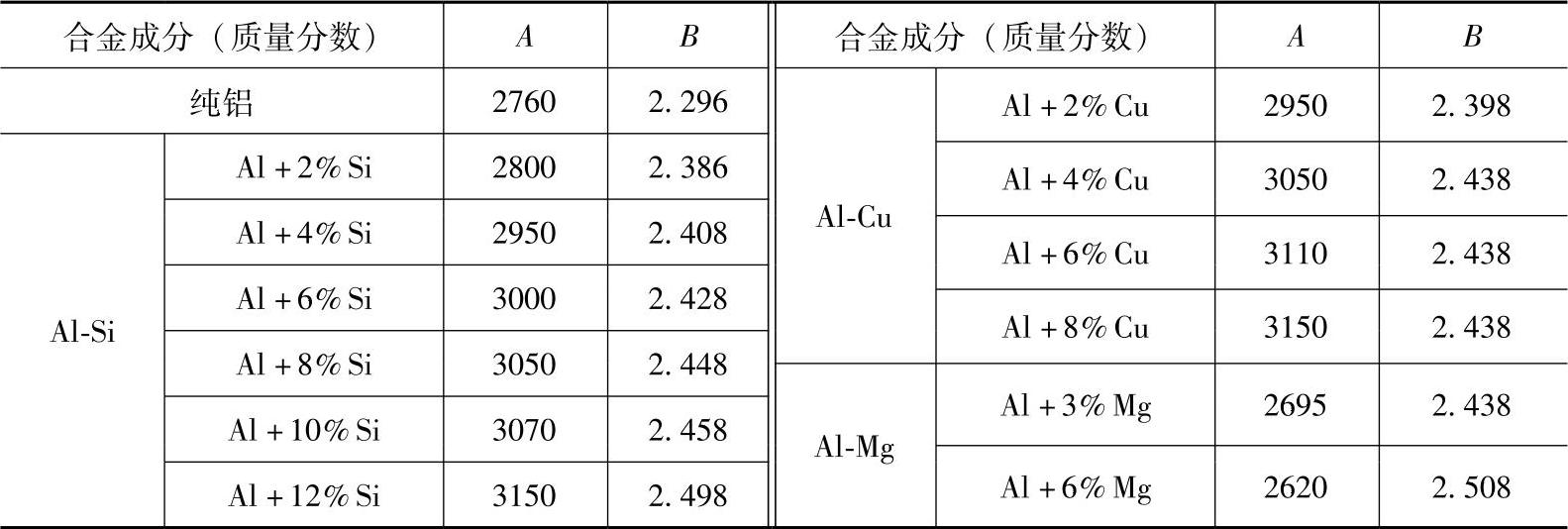
①合金元素对铝液的氢溶解度有影响。在pH2=0.1MPa的条件下,测得Si、Cu、Mg对溶解度的影响,按式(1-15)算得常数A、B值见表1-6。
从表1-7中可见,铝液中Si、Cu含量越高,氢的溶解度越低。
对于Mg含量的影响,某些学者研究表明,Mg含量在一定范围内会增加氢的溶解度。例如,纯铝中氢溶解度为0.9cm3/100g,而wMg=5%的铝合金中氢溶解度增加到1.3cm3/100g,wMg=6%的铝合金则氢溶解度增加到2.9cm3/100g,然而再增加Mg含量则氢溶解度减少,在wMg=9%的铝合金中氢溶解度只有0.7cm3/100g。
此外,含1%Ni能提高溶解度,而含1.5%Mn则降低溶解度。Li、Zn等合金元素会增大溶解度[7]。
上面所述的合金元素都不形成氢化物,因此在合金液中的氢吸附是有限的。如在铝中加入能形成氢化物的金属元素,则铝对氢的吸附能力急剧增加。例如wTi=2.64%的铝合金能吸附、溶解的氢为24.8cm3/100g,而wZr=5%的铝合金能吸附的氢为44.5cm3/100g。
表1-7 几种铝合金中氢的溶解度公式中的常数值
②合金元素影响氧化膜的性能,从而影响铝液的吸氢。常用合金元素的氧化次序排列如下:Na→Be→Mg→Al→Ce→Ti→Si→Mn→Zn→Cr→Fe→Ni→Cu。Al以后的元素如Si、Zn、Cu等在铝液中不是表面活性元素,密度又较大,不富集在铝液表面,被炉气氧化后和Al2O3组成尖晶石型复杂氧化物γ-Al2O3·MeO(Me代表Zn、Si、Cu等元素)。这种氧化物仍具有γ-Al2O3的晶型,只是晶格常数发生变化,组织致密,对铝液同样有保护作用。
Li、Mg、Na、Ca等与氧的亲和力比Al大,是表面活性元素,密度又比Al小,富集于铝液表面,熔炼时,优先被炉气氧化。铝液中wMg>1.0%时,表面氧化膜即全部由MgO所组成,这层MgO组织疏松,单位体积密度之比η=VMgO/VMg<1,对铝液不起保护作用,故Al-Mg类合金必须在熔剂覆盖下进行熔炼。
在改变氧化膜性能方面,最突出的是Be,它比铝轻,富集在铝液表层,优先被氧化,生成的BeO蒸气压很低,非常稳定。熔炼Al-Mg类合金时,BeO填补了MgO疏松组织中的空隙,使这层复合氧化膜的η>1,对铝液能起保护作用;此外,BeO的电阻很大,能阻止电子交换过程,防止Mg原子透过表面氧化膜和炉气接触而进一步被氧化,因此是一种非常有效的防氧化剂。在ZL301合金中加入0.03%~0.07%(质量分数)的Be,就能使氧化速度和纯铝相近,从而保护Al-Mg合金液。
加入硫,和镁反应生成MgS,也能成为氧化膜的填充剂,提高氧化膜的保护功能。
4)熔炼时间对吸氢的影响。由于在大气中熔炼铝合金,铝液不断被氧化,因此熔炼时间越长,生成的氧化夹杂越多,吸气也越严重。因此,在生产中,应遵循“快速熔炼”原则,尽量避免铝液在炉内长期停留。若除气精炼后较长时间内铝液还未浇注完毕,则炉内剩余的铝液可能又会重新吸氢,使铝液含氢量重新增高,这种情况下需要再次进行除气精炼。
(4)铸件中气孔的形成机理
1)铝液中氢气析出的热力学条件。根据氢在纯铝液中的溶解度公式(1-16),当铝液液面的氢气分压力或水蒸气的分压力降低的时候,氢的溶解度下降,实际氢含量超过其溶解度时形成过饱和,氢就具有了析出的条件。
从图1-6及式(1-16)也可得知,若气体分压力保持不变,铝液温度从高温降到较低温度时,氢的溶解度也降低,氢都将自铝液中析出。上述热力学条件能表示析出氢的方向和限度。
2)动力学过程。若要了解铝液析出氢的速度和最终结果,必须分析其动力学过程。铝液析出氢的动力学过程包括下列几个环节。
①氢气泡的形成。铝液析出氢的形式有两种,一种以气泡形式析出,它是脱氢初期的主要形式;另一种是扩散析出。
②铝液中形成的气泡上浮至熔池表面。气泡上浮速度由Stokes公式估算。通常气泡上浮速度不是铝液脱氢过程的限制性环节。
虽然氢在铝液中的扩散系数比合金元素在铝液中的扩散系数高2~4个数量级,但在铝液脱氢过程中,扩散却是一个决定脱氢速度的限制环节。
氧化夹杂明显降低氢的扩散系数,铝液中的合金元素如Si、Mg、Cu、Ti等都降低氢的扩散系数,尤其是氧化夹杂影响大,阻滞铝液脱氢。
铝液由熔池底部向液面造成定向运动,形成对流,加大氢的扩散速度,在促使气泡在快速生成、长大的同时,快速上浮至液面而被除去,提高除气效果。为此,在生产中可采取下列工艺措施:
a.电磁搅拌:在熔池内造成强制对流。
b.冷凝除气:依靠熔池表面层、坩埚壁的空冷,使铝液产生自然对流。
c.真空处理:藉氢气泡上浮带动铝液产生对流。
采取上述工艺措施后,氢在铝液中的扩散不再是脱氢除气的限制环节。此时,氢气泡通过铝液表面氧化膜成为脱氢过程的限制性环节。
③气泡通过表面氧化膜逸出。铝液中氢气泡通过表面氧化膜逸出是脱氢过程的最后阶段。由于铝液的表面氧化膜组织致密,强度高,因此气泡逸出的速度取决于相界面上存在的氧化膜组织。能破碎、溶解表面氧化膜的熔剂,可消除气泡逸出的屏障,提高铝液脱氢速度。如真空处理时,通常覆盖一层熔剂,氧化膜溶入熔剂中,气泡能顺利逸出,使除气效果大大改善。
在铝液内部,如果氧化夹杂含量高,氢气泡表面被氧化膜包覆,氢气渗入气泡的扩散受阻,同样成为脱氢过程的限制性环节。如果通入惰性气体Ar或不溶于铝液的活性气体Cl2、C2Cl6、CCl4等,则氢气可直接向这些气体所形成的气泡中迁移,然后被气泡带出液面,从而提高除气速度,详见1.5.1节。
(5)气孔的形态及危害
在铝液中溶解的气体(主要是氢气),若原始H含量高,则在浇注后的凝固过程中将形成气孔。对在铝型材、铸件或制品上产生的气孔缺陷,根据产生的原因分为气孔和微收缩孔。气孔是因为铝合金吸收的气体在铸件(铸锭)凝固时放出所形成的,从外表看,多为圆形,并且表面光滑;而微缩孔则是伴随着合金在浇注后的凝固收缩而发生的,往往呈尖形,内表面较粗糙。根据气孔的形状大小和分布特点,可把其分为针孔、皮下气孔、集中性大气孔三类。
1)针孔。按其大小和分布情况,可分为点状针孔、网状针孔、混合性针孔三类。
①点状针孔。用放大镜看,外形呈圆点状,轮廓清晰,内壁光滑。可测得其直径和单位面积上的个数。这种针孔是从合金液内析出的气泡所形成的,如图1-15所示。
②网状针孔。每个针孔几乎都连接起来,从大面看,呈密集的网状,无法数出单位面积上的孔数和测量其直径。它们是凝固温度范围宽的合金在冷却速度很慢时,堵塞封闭在枝晶间隙间的气体不能扩散聚集长大而形成的。
③混合性针孔。其大小和形状介于前两种气孔之间,用放大镜看,其形状不呈圆点状,而像蜂窝状,有密集区也有稀疏区。
针孔使合金的力学性能和耐蚀性能大大下降,阳极氧化性能和气密性也受到影响,甚至使产品(如厚度为0.06mm的铝箔等)报废。

图1-15 ZL101铝合金铸件含氢量较高时的针孔
2)皮下气孔。顾名思义,这是产生在铸件或铸锭表皮底下的一种气孔,其孔内表面光滑,多为铝液与湿型砂(潮模)或涂有过厚涂料的钢模发生化学反应而产生的。这种气孔虽对铸件的力学性能、耐蚀性等影响较小,但影响外观和尺寸。
3)集中性大气孔。集中性大气孔的特点是内壁光滑、比较深,多发生在壁厚肥大或靠近补缩冒口处,这是由于这些部位后凝固冷却,铸件内的气体受压力影响向这些部位集中的缘故。这种气孔会使铸件报废。
微缩孔则使合金的力学性能、耐蚀性能、气密性下降,导致铸件或型材的报废。
气孔和微缩孔的产生与合金液的含气量和合金液的凝固速度有关。合金液中含气量越多,则铸件(铸锭)中产生气孔和微缩孔也越多;合金液凝固时的冷却速度越快(如在金属型中自由铸造、压铸、熔体锻造等),因固溶入合金中的气体量多或在压力下凝固,就越不容易产生气孔和微收缩。反之,凝固时的冷却速度慢(如在砂型或石膏型中自由铸造),则即使合金液小含气量很少,也会产生气孔和微收缩。
3.夹杂物的形成及危害
所谓夹杂物或夹渣,是在熔炼或铸造过程中产生的金属或非金属氧化物、卤化物等,对金属或合金的加工性能、力学性能,以及制品的表面质量、色泽等带来不利影响。了解这些夹杂物的形成过程(来源)、类型、特点及其危害,在熔炼与铸造过程中如何防止或减少,对确保产品质量、节能降耗,提高经济效益有重要作用。
(1)夹杂物的分类及特点
对铝合金的夹杂物,按其大小、形态可分为块状夹杂物和弥散夹杂物两种;按结构类型,可分为熔铸中产生的非金属物(氧化物)、金属间化合物、盐、硼化物、碳化物和外来夹杂物六种。
1)大块夹杂物和弥散夹杂物。大块夹杂物是指其平均大小(尺寸)在5μm以上的氧化物(或氧化膜)等,它分散在合金液里或飘浮在液面上、弥散夹杂物是指其平均大小(尺寸)在5μm以下的很细小的氧化物等,它大部分悬浮在合金液里,很少部分飘浮在液面上。
2)熔炼、铸造中产生的非金属物(氧化物)。这是伴随着熔化到浇注的操作过程中,由于炉料、溶剂、变质剂和氧气、水蒸气等相互发生复杂的化学反应而产生的一类非金属(或氧化物)皮膜、片状或分散的夹杂物。图1-16所示为Al-5Mg合金试样断口的氧化膜皱褶的SEM图像。此类非金属物又主要分为下述三种。
①γ-Al2O3及α-Al2O3。如前面“铝液的吸气”中所述。
②氧化镁(MgO)。这也是一种由熔融合金与氧气、水蒸气等直接接触而被氧化生成的氧化物,其外形呈分散的群体皮膜状、簇状等形态,大小在5μm的较多,厚度在1~8μm,呈黑色。
③尖晶石(MgAl2O4)。这是熔融合金表面被炉气包围、当温度升到500℃以上时,合金液被直接氧化所形成的氧化物。其外形呈簇状或皮膜状。当合金液中有MgO夹杂物时,将更促使其形成。
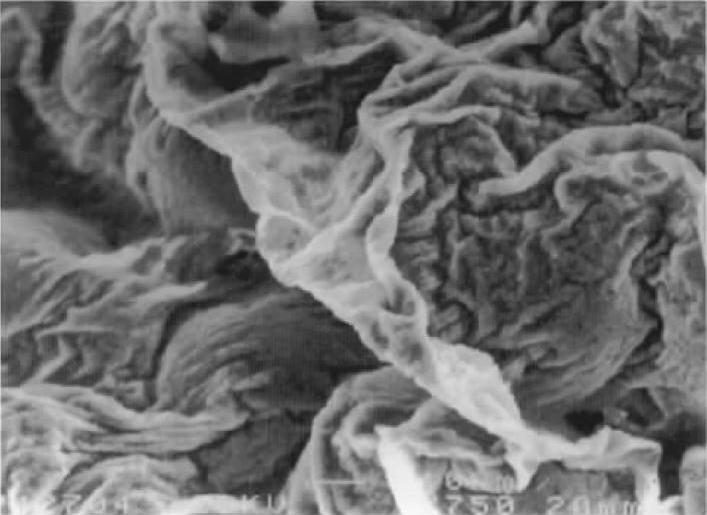
图1-16 Al-5Mg合金断口的氧化膜皱褶的SEM图像
3)金属间化合物。由于Al对其他元素的固溶度很小,所以即使其合金中所含不纯物在规定的限额内,那些不纯物与不纯物之间和不纯物与合金成分之间,也都会产生金属间化合物。这些金属间化合物呈不定型的汉字状、粒状或针状,如FeAl3、Al5FeSi、Al15(Mn,Fe)3Si2等,后者为最典型的金属间化合物。这些金属间化合物多在合金凝固时,作为共晶成分结晶出来,即使经过热处理,仍保持原来的形状。如前所述,对这些夹杂物,可通过变质处理、急冷凝固等办法,使其结晶晶粒细化,使之不致影响合金的性能和形成铸件或型材、制品的缺陷。
4)卤化物盐。这是为了去除铝液中的氢气等气体和夹杂物,而使用氯气或氩气与氮-氯气的混合气体,以及使用氯系熔剂作精炼剂时所产生的副产品。其反应式为
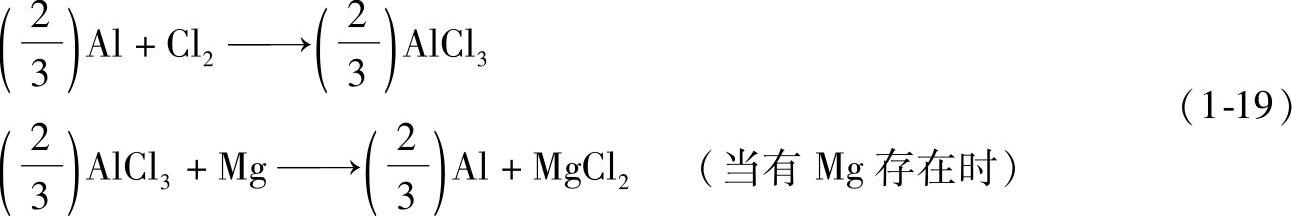
式(1-19)中产生的MgCl2,根据温度不同,呈液相或固相两态存在。
用作变质剂的Na和用作熔剂的Ca,也会形成呈固态的NaCl、CaCl2盐粒子。由于这些化合物的颗粒较细,很难用过滤器把它们去除。
5)硼化物。这是由于在对铝液作去气除渣的精炼处理时,使用了含有硼化物[如硼酸(H2BO3)、氟硼酸钠(Na3BF6)等]的熔剂成分所产生的副产品AlB2、TiB2等六角形或矩形板状的硼化物,它们或呈暗灰色,或呈褐灰色。
6)碳化物。在使用除气除渣剂六氯乙烷C2Cl6等精炼剂对铝液进行精炼处理时,产生了Al4C3等碳化物。其反比式为
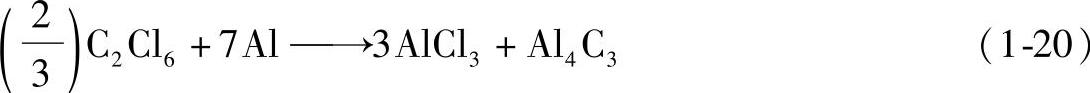
形成的碳化物Al4C3会随AlCl3上浮到合金液的表面熔渣中,在撇渣时可撇除。其粒径达到40μm以上,则成为坚硬的黑点。
7)外来夹杂物及炉衬材料反应生成物。主要是耐火材料的崩落物,或耐火材料与合金、熔剂、精炼剂的反应生成物。
①使用SiO2质耐火材料时,SiO2与Al、Mg发生下述反应:

生成的这些Si会进入合金液中成为杂质。所以熔炼铝合金不能使用这种既损坏炉子,又污染合金液的耐火材料,而要使用高铝质耐火砖(含Al2O3量高)作炉衬材料。
②使用熔融盐作熔剂时,会使耐火材料毁坏、崩溃,这些崩溃的耐火材料进入合金液,又被Al还原,形成Al2O3氧化物夹杂。
③使用含碱(碱土)金属元素的熔剂与Al-Mg合金中的Mg发生化学反应:

反应所产生的Na也存在于合金液中,成为污染合金液的杂质。
大部分氧化夹杂物的熔点高,密度比铝合金小,化学性能稳定,很难通过热处理和重熔来改变其形态,也很难用化学方法把它分解出来。
(2)夹杂物的危害
混入铝合金中的夹杂物,在铸件或铸锭凝固后,便以固态分布于合金的晶体内、晶界或局部区域,对合金的性能、产品质量和生产加工过程带来严重危害。
1)大块夹杂物和弥散夹杂物。大块夹杂物,特别是其中的平均大小达到20~30μm(或直径达到1mm以上)的夹杂物的危害如下:
①割裂金属或合金的组织,使产品渗漏,并成为以后造成腐蚀的根源,还显著降低合金的力学性能,特别是伸长率和冲击韧性及疲劳性能。
②降低合金液的流动性,给铸造工艺带来困难。
③使切削加工性能变坏。
④使铸件在机械加工中开裂。
⑤使铸件在热处理时起泡。
弥散夹杂物(平均颗粒尺寸在20μm以下)使合金液的粘度增加,降低合金液的流动性(特别是凝固时的补缩能力),阻滞气体的扩散和析出,促使铸件(铸锭)形成气孔。但是,若极微细的氧化物质点(10-3~10-5mm)分布均匀,则有很高的强化合金性能的作用,特别是可显著地提高合金的高温强度。
2)皮膜状的氧化铝。皮膜状氧化铝若混入合金液中,就会在铸件(铸锭)凝固中,成为气泡的成核中心,是产生气孔的最危险的夹杂物。
3)金属间化合物。金属间化合物平均大小在10μm以下,则会稍微降低合金的伸长率和冲击韧性,但抗拉强度和疲劳强度还稍有提高,所以实际上可以不认为是缺陷。如在压铸件中,即使wFe达到1.7%(如YL112、ZL401),因为与Fe形成的金属间化合物是防止粘模所必要的,但其平均直径达到20μm以上,则成为坚硬的黑点,使合金脆化,给切削加工造成困难,并成为吸附气体、形成气泡的核心。
在合金液保温中生成的泥浆状的金属间化合物,熔点高,成长快,晶体粗大,卷入铸型后成为粗大的阻碍切削加工的坚硬的黑点,金属间化合物TiAl3、TiB2的粒子大小在5μm以上时,会使合金的力学性能和耐蚀性下降。
4)Na。Na在高镁合金中,会游离存在于晶界,降低合金的强度,致使合金或铸锭在热轧过程中产生严重的裂纹,即出现通常所说的“钠脆性”现象,所以,高镁铝合金中的wNa要严格控制在≤5×10-6的范围内,其他合金的wNa则控制在15×10-6左右。
5)AlCl3和MgCl2等卤化物盐粒子。碳化物、卤化物盐粒子熔化温度高,如混入合金液中,将成为降低合金力学、物理性能、耐蚀性,增加吸气的夹杂物。
6)硼化物、耐火材料等。硼化物、耐火材料,以及耐火材料与熔剂、精炼剂、合金液的反应生成物等外来夹杂物,多为密度小、硬脆、化学稳定性好的质点,它们存在于合金中会严重降低合金的力学性能、物理性能、加工性能和气密性能。
有关有色金属熔炼入门与精通的文章

若在镁液中添加少量的Be可以提高镁熔体的抗氧化能力。这是因为Be是镁的表面活性元素,富集于镁熔体表面,致使熔体表面含Be量为合金的10倍,并优先氧化。BeO的致密度系数α=1.7l,故BeO充填于氧化膜孔隙中形成致密的复合氧化膜。氮还能与镁合金中的元素反应,生成氮化物,形成非金属夹渣,影响金属的纯度,直接影响合金的耐蚀性和组织上的稳定性。实验研究表明,在700℃下采用密封坩埚熔炼镁合金,CO2的防护性尚好。......
2023-06-22

铜及其合金在熔炼时具有氧化性、挥发性、吸气性和吸杂性。铜合金的熔炼温度通常在1000℃以上,在这一温度下,CuO的分解压约为0.01Pa,远低于大气中氧的分解压21000Pa,因此在空气氛围中熔炼铜及其合金,将难以避免氧化。铜合金在熔炼过程中所存在的上述特点都会降低熔炼质量,应采取适当的措施尽量将损失降至最低。......
2023-06-22

表面抛光 铝及铝合金型材或制件,视表面粗糙度情况及客户或产品设计的要求进行抛光处理,如表面已经达到理想的表面粗糙度,则不必再抛光。脱脂 铝及铝合金制件可根据表面的油污情况选择脱脂方法,如果油污厚重,可以先用有机溶剂脱脂,然后再进行化学脱脂。碱腐蚀 铝合金制件表面经脱脂及热水、冷水洗净后,表面仍有一层旧的氧化膜,这层膜在阳极氧化前要用碱蚀清除。......
2023-06-22

受制于气流扩散速度的燃烧称为扩散燃烧。图2-2 CO系各反应的ΔG0及KP随温度的变化在还原带,高于705℃,反应即可进行,而低于705℃时,CO2不能还原。碳的燃烧产物主要是CO2,当逐渐到达氧化带上部,氧气浓度下降,C、O2分子碰撞的次数大幅减少时,CO才能逐渐增多。假设O2、CO2、CO等气体的体积分数仅沿底焦的高度变化,且在底焦横截面上均匀分布。......
2023-06-24

前面所举的铝及铝合金阳极氧化膜封闭工艺都是在加热的条件下进行的。为克服上述种种缺陷,近年来研究并开发出各种常温封闭工艺,并且有了很大的发展,目前,已经成为铝及铝合金阳极氧化膜封闭的主要处理手段。......
2023-06-22

表262 镁合金与铝合金阳极氧化处理的工艺流程比较①质量分数68%的浓硝酸与水以体积比1∶1配制。在铝的硫酸阳极氧化过程中形成的多孔结构则是形成的氧化铝层在电解液部分溶解的结果,孔径大约为0.1μm。......
2023-06-22

在合金的真空熔炼过程中,元素的挥发损失将主要是Al元素的挥发损失。真空熔炼的目的是避免气氛中间隙元素对合金的污染,而TiAl合金熔体中的主要成分铝具有较高的饱和蒸气压,在真空熔炼过程中极易产生挥发损失,严重影响合金成分的准确性,而且挥发产物污染真空系统。因此熔炼TiAl合金时,为了防止合金熔体中铝的沸腾,真空度不宜过高,应不超过临界值。......
2023-06-22

表2-10 冲天炉炉渣成分2)炉渣的性质①渣的黏度。图2-24所示为不同成分炉渣的熔化性温度,可供调整渣成分及温度的参考。2)被炉气中的O2氧化。铁料在熔化带一开始熔化即会被渣中FeO氧化脱碳,表面锈蚀的铁料会增加渣中的FeO含量,导至铁液脱碳加剧。4)被铁液中溶解氧氧化。......
2023-06-24
相关推荐