计算机模拟,又称为计算机仿真,是指利用计算机程序建立研究对象的数学模型或描述模型,并在计算机上加以体现和试验。这是关系到计算机模拟是否有效的关键问题。计算机模拟与计算机硬件和软件技术的发展关系非常密切。在微观尺度上,微观粒子的结构和性质起重要作用,所以计算机模拟可用于反应机理模拟研究等。......
2023-07-15
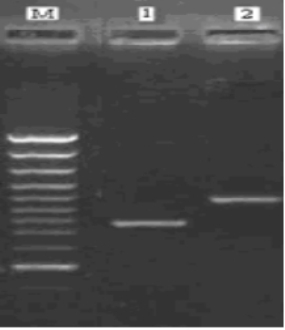
图2.1.6 {[Fe(phen)(H2O)3]2O}4+与dsDNA作用后的电泳谱带图
图2.1.7为{[Fe(phen)(H2O)3]2O}4+与dsDNA和ssDNA相互作用的循环伏安图。当溶液中加入2.68×10-7mol/L dsDNA充分反应后,p1和p2均出现显著降低,表明最初的双核铁配合物和其EC-C单核产物均与dsDNA发生了强烈的相互作用(图2.1.7b),然而,值得注意的是当与dsDNA发生相互作用以后,p1和p2的峰电位向相反的方向偏移。Bard等[128]曾指出,电活性小分子与DNA相互作用后的电位偏移方向与二者的结合模式有关,当峰电位出现正移时,表明小分子与DNA发生了嵌插作用,反之,则可能为静电结合作用。据此,我们判断,双核铁配合物与dsDNA可能发生了静电作用,而其EC-C产物则可能是通过嵌插模式与dsDNA发生结合作用的。
图2.1.7c为溶液中加入ssDNA后的循环伏安图。对于p1,其峰电位和峰电流的变化与加入dsDNA的情况一致,表明双核铁配合物与ssDNA之间的静电作用仍存在;但是,与未加入DNA情况相比(图2.1.7a),加入ssDNA后,p2的峰电位与峰电流几乎未发生改变,表明单核铁配合物与ssDNA的作用已经减弱或消失,这可能是因为天然DNA经过变性后,其双螺旋结构遭到破坏,导致嵌插作用的消失。因此,根据上述实验,我们可以得到结论:标题氧桥联双核铁配合物和其单核EC-C产物与DNA是通过不同的作用模式结合的,即通过标题化合物在金电极上的两步电化学过程,可以达到识别ssDNA和dsDNA的目的。为了进一步证明这种结合模式的差异,我们在溶液中加入不同量KCl进行了离子强度(μ)影响实验。

图2.1.7 {[Fe(phen)(H2O)3]2O}4+与dsDNA和ssDNA相互作用的循环伏安图
图2.1.8为离子强度对p2峰电位的影响。与dsDNA反应前,p2峰电位随着离子强度的变化而出现的偏移值通过关系式ΔEp2,a=Ep2,a-Ep2,a,μ=20求得,式中Ep2,a,μ=20和Ep2,a表示不含dsDNA的溶液中加入KCl前后p2的峰电位,下标μ=20(mmol/L)为溶液中仅有0.01 mol/L NaOAc-HOAc支持电解质时的离子强度。同理,当配合物溶液中加入dsDNA后,由离子强度引起的p2峰电位偏移值ΔEp2,b通过关系式ΔEp2,b=Ep2,b-Ep2,b,μ=20求得。图2.1.8a和图2.1.8b表明,无论溶液中是否含有DNA,ΔEp2,aand ΔEp2,b均随着离子强度的升高越来越负,即p2峰电位随离子强度升高而逐渐负移。但是,由图2.1.8c可知,加入dsDNA前后,象征离子强度对[FeII-phen]2+与dsDNA相互作用影响的p2峰电位偏移,即ΔEp2,a与ΔEp2,b的差值,ΔEp2°=ΔEp2,b-ΔEp2,a,在整个过程中均呈正值且随离子强度升高而增大。根据文献[129]可知,若离子强度升高引起小分子与DNA相互作用后峰电位正移则表明二者发生了典型的嵌插作用,这与前面图2.1.7讨论的关于单核铁配合物与dsDNA发生了嵌插作用的结果一致。
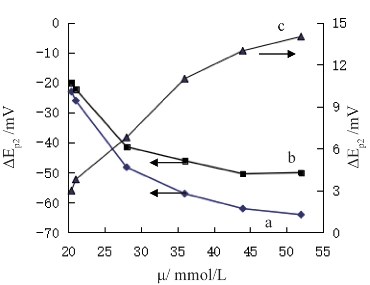
图2.1.8 离子强度(μ)对p2峰电位偏移值的影响(ΔEp2)
同时,我们考察了离子强度对双核铁配合物,{[Fe(phen)(H2O)3]2O}4+,还原峰峰电位(Ep1)的影响。由图2.1.9可知,较Ep2相比,Ep1受离子强度表化的影响则相对复杂得多。当溶液中不存在dsDNA时,因离子强度引起的Ep1差值(ΔEp1,a)仍为负值且逐渐减小,表示Ep1也随着离子强度大的增大而负移(图2.1.9a);但当溶液中加入dsDNA且充分反应后,p1的峰电位随离子强度升高产生的差值(ΔEp1,b)减小,然后在μ=24 mmol/L 处经过一个转折点又逐渐增大(图2.1.9b),这表明,在溶液中加入dsDNA后,p1的峰电位先负移,当溶液中离子强度大于24 mmol/L 后,Ep1又开始正向移动。同样,为了考察离子强度对配合物与dsDNA相互作用的影响,我们以Ep1的相对偏移值,ΔEp1°(ΔEp1°=ΔEp1,b-ΔEp1,a)对μ做图,结果如图2.1.9c所示。在整个离子强度增大过程中,ΔEp1°~μ曲线被虚线分为两个区间,分别对应于ΔEp1°<0 and ΔEp1°>0。这也表明,在离子强度增大过程中,双核配合物与dsDNA之间从静电作用转变为了嵌插作用[129]。曲线上ΔEp1°=0 对应的μ=29 mmol/L分割点被称为临界离子强度(CIS),意味着在该临界点点上,配合物与dsDNA之间的静电作用力与嵌插作用力相等[129]。

图2.1.9 离子强度(μ)对p1峰电位偏移值的影响(ΔEp1)
根据Debye-Hückel理论[185],当二者发生静电作用时,ΔEp1°应该与μ1/2呈良好的线性关系。图2.1.10即为ΔEp1°与μ1/2之间的关系图,由图可知,当μ< 28 mmol/L时,ΔEp1°~μ1/2具有良好的线性关系,ΔEp1°/(mV)=7.0576μ1/2/(mmol1/2)-38.268,表明在这一离子强度范围内,静电作用占主导地位。当μ>28 mmol/L,ΔEp1°开始偏离直线,再次证明了上述关于{[Fe(phen)(H2O)3]2O}4+与 dsDNA的相互作用从静电模式至嵌插模式的转变。
另外,根据公式ΔE0´=ΔE10´+Bμ1/2(CKCl<<1mol/L)[185]和ΔE10´=(-RT/nF)ln(KO´/KR´)[128],我们从ΔEp1°~μ1/2直线截踞可以计算出{[Fe(phen)(H2O)3]2O}4+/{[Fe(phen)(H2O)3]2O}2+两种氧化形态与dsDNA相互作用的极限结合常数比(KO´/KR´),式中,ΔE10´为μ=0的极限式电位差,B为价态,环境温度,溶剂密度等有关的常数。在本书中,从图2.1.10截距-38 mV,计算得{[Fe(phen)(H2O)3]2O}4+、{[Fe(phen)(H2O)3]2O}2+与dsDNA相互作用结合常数比为19,这也表明了{[Fe(phen)(H2O)3]2O}4+与dsDNA之间的主要结合模式为静电作用[129]。

图2.1.10 ΔEp1°与μ1/2之间的关系曲线图
综上所述,在确定电化学反应机理的基础上,通过观察在溶液中加入dsDNA和ssDNA后配合物电化学信号的变化及离子强度对各自配合物特征峰电位的影响,我们发现标题双核配合物及其EC-C产物与dsDNA和ssDNA具有不同的结合模式,这种结合模式的差异可用于对dsDNA和ssDNA结构属性的识别。

图2.1.11 离子强度对峰电流差值(ΔIp)的影响
同时,我们考察了离子强度对配合物和dsDNA相互作用峰电流的影响,结果如图2.1.11所示。前文已经提出,溶液中加入dsDNA后,p1和p2峰电流均出现降低,产生差值分别为ΔIp1和ΔIp2。图2.1.11表明,随着溶液中离子强度的升高,ΔIp1和ΔIp2均逐渐减小,表明标题双核铁配合物和其EC-C产物与dsDNA的相互作用程度逐渐减弱。这可能是因为,在高离子强度条件下,溶液中过量的正电荷K+与dsDNA外围负电荷的磷酸二酯基团发生静电结合,对dsDNA产生屏蔽效应,导致正电荷配合物与dsDNA之间相互作用力减弱[128]。

图2.1.12 配合物{[Fe(phen)(H2O)3]2O}4+在不同电位扫描速率(ν)下的循环伏安图。 插图:p1和p2峰电流(Ip1和Ip2)与扫速平方根(ν1/2)的关系图。
图2.1.12(a)和图2.1.12(b)分别为配合物中加入dsDNA前后,电位扫描速率(ν)对循环伏安图的影响。结果发现,p1和p2峰电流(Ip1和Ip2),均与扫描速率的平方根(ν1/2)呈良好的线性关系(图2.1.12中插图),表明,无论是否是dsDNA发生结合作用,配合物在电极上的电化学反应均受扩散控制。另外,溶液中加入dsDNA充分反应后,Ip-ν1/2曲线的斜率出现明显降低,说明溶液中电活性物质的表面扩散系数降低,使得单位时间里从本体溶液中扩散至电极表面的分子数减少,这是加入DNA后,配合物峰电流降低的原因。
将p1和p2加入dsDNA后的峰电流差值(ΔIp1and ΔIp2)分别对dsDNA的浓度(CDNA)做图,结果如图2.1.13所示。对于p1,ΔIp1与CDNA在9.36×10-7-9.36×10-6mol/L和9.36×10-6-7.49×10-5mol/L两个浓度区间呈良好的线性关系,关系式分别为ΔIp1/(μA)=0.0253 CDNA/(μmol)+6.3093,γ=0.9854和ΔIp1/(μA)=0.2836 CDNA/(μmol)+3.9489,γ=0.9979。然而,对于p2,当CDNA小于1.87×10-5 mol/L 时,ΔIp2与CDNA有良好的线性关系,ΔIp2/(μA)=0.1614 CDNA/(μmol)+1.9399,γ=0.9989,之后,ΔIp2趋于稳定,表明二者相互作用完全。因为,在分析中,p1具有更宽的检测范围,我们以p1为分析目标,考察了干扰物质对检测的影响,结果如表2.1.1所示。由表可知,在所试验的共存物质浓度下,除Fe3+外,大多数金属离子和生物分子对dsDNA的测定干扰的相对误差均小于±8 %,表明该体系对dsDNA的测定具有较好抗干扰性,可直接用于dsDNA的定量分析。
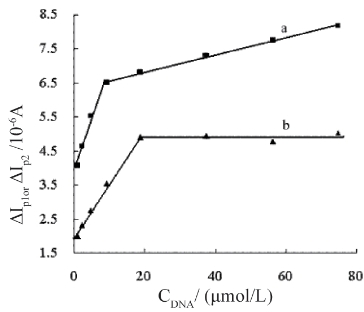
图2.1.13 ΔIp2(a)and ΔIp1(b)与dsDNA浓度(CDNA)关系曲线
表2.1.1 共存物质对测定7.37×10-6 mol/L dsDNA的影响

有关金属基核酸探针的电化学传感应用的文章

计算机模拟,又称为计算机仿真,是指利用计算机程序建立研究对象的数学模型或描述模型,并在计算机上加以体现和试验。这是关系到计算机模拟是否有效的关键问题。计算机模拟与计算机硬件和软件技术的发展关系非常密切。在微观尺度上,微观粒子的结构和性质起重要作用,所以计算机模拟可用于反应机理模拟研究等。......
2023-07-15

在高压和超高压电力系统中,一般采用大电流接地系统,这种接地是工作接地,其目的是降低电气设备的绝缘水平,防止系统发生接地故障而引起过电压,免除由于单向接地后继续运行而形成的不对称性。电力系统的接地网是维护电力系统安全可靠运行、保障运行人员和电气设备安全的重要措施。良好的接地对于电力系统正常运行具有极其重要的作用。......
2023-06-23

松香的钎剂作用在于所含的松香酸,去膜机理属有机酸一类。目前,由于CFC的禁用使得人们把钎剂的研制转移到水洗钎剂和免洗钎剂上。水洗钎剂的可靠性取决于水清洗钎剂残渣的“干净”程度。免洗钎剂具有较低的固体含量,焊后无需清洗,主要以有机酸作为活性剂,有时也会有胺的存在。......
2023-06-26

接地降阻剂是指埋设在接地体周围以降低接地装置接地电阻的有机和无机化合物。其效果,对固体降阻剂和膨润土类降阻剂最为明显,而化学降阻剂和树脂状的降阻剂随着时间的流失,有效截面的增大则不太明显,会越来越小。某些降阻剂具有较强的吸水性和保水性,如膨润土类降阻剂,具有较强的吸水性,吸水后体积膨胀并能长期保持水分成为浆糊状,使接地电阻一直保持稳定不受气候的影响。......
2023-06-27

1.内资企业与外资企业之间的竞争是促进东道国企业主动吸收与创新,从而促进FDI发生溢出效应的关键作用机制竞争促进溢出效应的作用机制主要是在内资企业受到生存压力的情况下发挥作用的。......
2023-11-29

离子交换膜是电渗析器的重要组成部分,它是一种具有选择透过性能的高分子片状薄膜。因此实用的离子交换膜应具有以下的基本要求。离子交换膜的选择性透过机理和离子在膜中的迁移历程可由膜的孔隙作用、静电作用、和在外力作用下的定向扩散作用等说明。脱盐用的离子交换膜孔径多在几个至20。扩散作用依赖于膜内活性离子交换基和孔隙的存在,然而离子的定向迁移是外加电场力推动的结果。......
2023-06-19

狭义的油气资源在商业上一般指液态的原油和气态的天然气。在这一点上,学者们的观点是相同的,均认为油气产业包括勘探、开发、生产、储运、炼制加工和销售等业务活动。......
2023-11-27

图3.17纳米发电机GDNw湿气产电的过程机理第二阶段,在脱水过程中,当环境相对湿度回落到初始状态,湿度快速下降。这些结果证实了水合诱导产生正电压以及脱水引起负电压。根据图3.16中的装置对GDNw纳米器件进行湿气产电的性能测试。图3.18和3.18表示的是基于GDNw的产电器件能够产生稳定的脉冲电压和电流,在相对湿度为80%时,产生的电压值约为72 mV,在相同条件下,产生的电流值约为45 nA。图3.19中的实线三角形是GDNw中S元素的浓度分布。......
2023-06-30
相关推荐