【摘要】:归其原因,破坏反应物的化合键,将氢分子裂解后的氢原子分离,将氧分子裂解后的氧原子分离,这些过程并不会自动发生。图6-1给出了化学反应过程中每摩尔能量的演变过程[2]。图6-1 在水生成反应过程中的摩尔能量与化学势演变过程我们注意到,能量分布图的轮廓衍生出了“活化壁垒”这个术语,如要生成最后产物,反应系统必须越过这个“壁垒”。
通常,即使通过热力学分析说明一个反应过程是释放能量的,如果只将反应所需物质简单地放入容器内,还是不足以促使它们发生本该发生的化学反应。归其原因,破坏反应物的化合键,将氢分子裂解后的氢原子分离,将氧分子裂解后的氧原子分离,这些过程并不会自动发生。要想让它发生必须为其提供能量。我们称这个能量为反应活化能,表示为ΔrG≠,而且这个能量绝对和反应能量一样重要,甚至更重要。图6-1给出了化学反应过程中每摩尔能量的演变过程[2]。

图6-1 在水生成反应过程中的摩尔能量与化学势演变过程
我们注意到,能量分布图的轮廓衍生出了“活化壁垒”这个术语,如要生成最后产物,反应系统必须越过这个“壁垒”。活化能可以由非化学能的形式很好地提供,比如热能、电能、机械能等。我们所熟知的电火花激发氢、氧结合反应就是一个例子。
同时我们还知道,一旦给这个反应过程提供活化能,氢、氧极快速地结合,发生爆炸,产生热,以及流体动能(压力和体积增加),这也是氢燃料热机的运行原理。
上述反应过程的主要问题是效率无法实现最优,这归因于反应过程太快,无法控制,而且反应是不可逆的[3]。为了能够控制反应,并使之在最佳的可逆的条件下进行,我们必须分析其中的反应细节。我们知道两个原子间的化合键是通过两原子间的电子交换形成的。一个氢原子拥有一个轨道电子,可将其借给氧原子,而一个氧原子需要两个外来电子才能形成稳定的外层电子层(补足8个电子)。最初的一个氢分子发生裂解,氢原子与其电子分离,形成两个氢离子(称为质子)和两个电子,即
H2→2H++2e- (6-9)
而接受了两个电子的氧形成氧的二价阴离子,即
1/2O2+2e-→O2- (6-10)
因此,式(6-8)所示的水生成反应,可根据上述反应(或采用电化学术语说得更确切点-两个“半反应”)写成另外一种形式。可以写成两个离子的关联,即两个电子向氧移动,最终形成生成物的化合键:
O2-+2H+→H2O (6-11)
任何涉及多个原子键的反应均可分解成几个基本的反应。当然,还有其他方法可以记录这些反应过程,但本节对其讨论到此为止,因为我们似乎已经找到了通过电化学控制化学反应的原理。譬如,将上面两个反应过程合成一个就可足以说明。
1/2O2+2H++2e-→H2O (6-12)
将此反应与反应方程式(6-9)相比,我们认识到,水生成反应的整个进程可以通过两个原始反应物之间的质子和电子交换来控制。在技术上,需要将反应物分别装在两个隔离室中,两个隔离室之间允许发生质子和电子交换,这样可以控制反应过程,防止反应过快。图6-2展示了控制氢燃烧的原理。
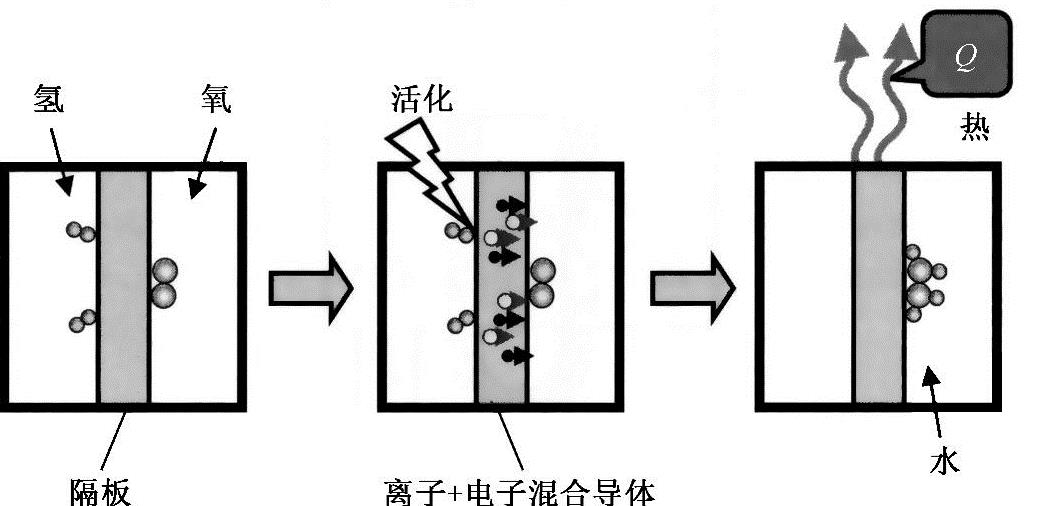
图6-2 控制氢燃烧的三个基本步骤[左图中氢和氧分别放在两个气室中。中间的图是通过提供活化能触发反应,质子和电子穿过隔板与氧结合。右图中气室中逐渐积满了生成的水,产生热散到外面。没有产生其他能量(流体动能、机械能、电能等)]
很明显,这个反应过程取决于隔板功能,它必须具有选择性,只允许质子和电子穿过,而气体和水却不能穿过。至于反应过程的动力性,我们需要考虑离子传输的动力,这也往往是限制反应速度的因素。
关于燃烧过程的控制,我们已经取得了进展,也可以通过更具有可逆性的反应形式改善反应效率,但除了热能之外,还不能回收到其他任何的能量。不过,使用外电路转移电子以提取电能是必然选择。为了提高电能提取效率,隔板务必同时具有极佳的电绝缘性和极佳的离子传输性,如此则效率可达60%。如果再为隔离室增加供气通路、排水通道,将图6-2所示系统就转变成了基于质子交换的燃料电池,如图6-3所示。(https://www.chuimin.cn)
每个隔离室需要一个导电体,也就是电极。收集电子的电极称为阳极,而将电子重新注入单体中的电极称为阴极[4]。
电能的变化有着和化学能相同的表示方式[即式(6-5)],不过带有相应的电动力类静态变量,即
dU=VdQ (6-13)
电压V类似于化学势的变化,而电荷Q类似于生成物nB的量。由法拉第关系式可以看出在后面这两个变量之间存在一个比例常数,或者是它们的变化量之间存在一个比例常数。我们这里所提及的表达式考虑了每个氧原子交换两个电子这一过程:
dQ=-2eNAdnB=-2FdnB (6-14)

图6-3 基于质子交换的燃料电池原理图 (电子用黑色小球表示,质子 用白色小球表示)
所谓法拉第常数,是基本电荷e和阿伏伽德罗常数NA的乘积,约等于96487C/mol[5]。这使我们可以利用前面的公式推导出电压表达式,即

所以,常压(一个大气压)常温(25℃)下,等量反应物的理论开路电压可由下式给出:

而在实际应用中,由于单体电池内阻的存在,会使开路电压下降零点几伏。
至此,我们已经分析完了燃料电池的基本原理,介绍了如何用氢和氧这两种物质产生电能。氢气的作用是形成质子而献出电子,这个过程称为氧化。这也是通常所说的氧化度增加反应(也就是正电荷数),不过这个词现在使用度不是很高。从逻辑上讲,它的逆向反应称为还原,氧原子负责接受电子。能够提供电子的物质称为“还原剂”;而能够接受电子的物质称为“氧化剂”。这些电化学术语有时分别以“燃料”和“燃烧剂”来替代。由此可见,任何能使还原剂“燃料”燃烧的氧化剂都能成为“燃烧剂”。应该注意到,“燃料”一词意味着它是能量转换过程的原材料,而“还原剂”反而使用更为普遍。
注意到我们曾经描述过的氢燃料电池的反应是可逆的,这一点很重要。也就是说,我们可以让燃料电池沿着相反的方向反应,利用电能制造化学能。这种情况下,反应消耗水和电子,生成氢气和氧气,这种现象称为电解。在燃料电池中使用的同样装置将用做电解槽。很明显,外加电压要高于燃料电池的单体电压至少1.6V。连接电解槽和燃料电池,接上储氢容器,当然还有储氧和储水装置,就形成一个自主运行的电能储存系统。“二次燃料电池”的运行原理由图6-4以“等效电路”的形式给出,而电能和化学能之间的转换由“通用变压器”表示。“通用电容器”代表储气容器;“通用开关”(阀门)负责通断储能和用电端口之间的联系(当然也应该允许用电和储能两种过程同时进行)。

图6-4 用电解槽(左)和燃料电池(右)将电能以化学能形式储存的转换装置等效电路图(开关的位置对应着不同的储存功能)
就目前的技术水平看,上述能量链的效率明显不佳,电解的效率比燃料电池的还低,为40%~50%。对于储能而言,可以采用热耦合的方式将燃料电池单体所释的热,用以解决电解槽用热之需,而且这部分存储的热量与储氢过程中的热量一道,最终以热电转换方式再利用,可以提高系统的总体效率。













相关推荐