水的软化目的是降低水的硬度。经石灰处理后,水的剩余碳酸盐硬度可降低0.25~0.5mmol/L,剩余碱度约0.8~1.2mmol/L,硅化合物可去除30%~35%,有机物可去除25%,铁残留量约0.1mg/L。阳离子交换树脂可以用于水的软化或脱碱软化,阴、阳离子配合一起则用于水的除盐。离子交换的软化方法目前常用的有Na离子交换法、H离子交换法和H-Na离子交换法等。......
2023-08-30
硬度是水质的一个重要指标。生活用水与生产用水均对硬度指标有一定的要求,特别是锅炉用水中若含有硬度盐类,会在锅炉受热面上生成水垢,从而降低锅炉热效率、增大燃料的消耗,甚至因金属壁面局部过热而烧损部件,引起爆炸。因此,对于低压锅炉,一般要进行水的软化处理;对于中高压锅炉,则要求进行水的软化脱盐处理。
硬度盐类包括Ca2+、Mg2+、Fe2+、Mn2+、Fe3+、Al3+等易形成难溶盐类的金属阳离子。在一般天然水中,主要是钙离子和镁离子,其他的离子含量很少,所以通常以水中钙、镁离子的总含量称为水的总硬度Ht。硬度又可区分为碳酸盐硬度Hc和非碳酸盐硬度Hn,前者容易煮沸时沉淀析出,亦称为暂时硬度,而后者在煮沸时不沉淀析出,亦称为永久硬度。
硬度单位以往习惯用meq/L,国外也有以10mgCaO/L作为一度(如德国),也有换算成mgCaCO3/L表示(如美国、日本)。他们之间的换算关系为
![]()
按照法定计量单位规定,硬度应统一采用物质的量浓度c及法定单位(mol/L或mmol/L)表示。一系统中某物质的基本单元数等于6022×1023(称为阿伏加德罗常数)时,则其物质的量n为1摩尔(mol)。基本单元可以是原子、分子、离子或是这些粒子的特定组合,但应予指明,包括由n导出的量如摩尔质量M、浓度c等。因此,物质的量n与基本单元的粒子数N和阿伏加德罗常数L之间的关系为
![]()
至于基本单元X的表示方法,可以采用Ca2+、Mg2+,亦可采用1/2Ca2+、1/2Mg2+,但以后者更为方便。它们之间的关系为
![]()
其通式写成
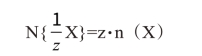
这里,x等于离子电荷数。在实用中,称x为当量粒子。这里因为当选用当量粒子作为基本单元时,以往的“meq/L”可代之以“mol/L”而数值保持不变。因此,在计算离子平衡时,例如在水的分析中,引用当量粒子概念比较方便。
另外,如以n表示物质的量(mol),以c表示物质的量浓度(moL),以m表示质量(g),以M表示摩尔质量(g/mol),以V表示溶液体积(L),它们之间的关系可表示成
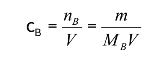
或

这里B泛指基本单元。
为了便于说明,下面通过实际计算加以比较。
【例题】根据水质分析,Ca2+和Mg2+含量分别等于848mg/L和510mg/L,试用各种表达方法表示其硬度。
【解】1.以mmol/L表示
(1)基本单元选用Ca2+和Mg2+
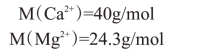
故物质的量浓度分别等于
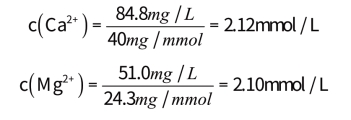
(2)基本单元选用1/2Ca2+和1/2Mg2+
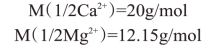
故物质的量浓度分别等于
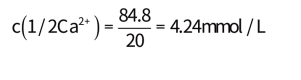
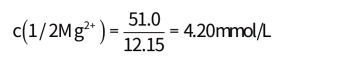
2.以meq/L表示
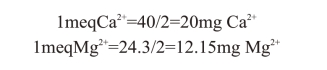
故当量浓度分别为
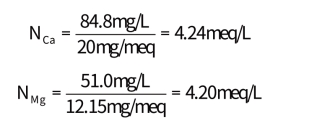
3.以mgCaCO3/L表示
基本单元选用CaCO3
![]()
故质量浓度分别为

4.以德国度(d)表示
基本单元选用CaO
![]()
![]()
故硬度分别等于

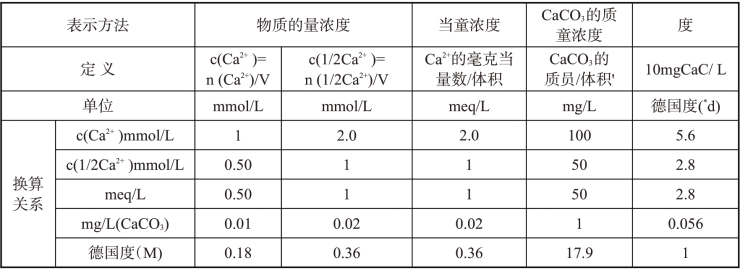
根据以上实例计算可知,以物质的量浓度表示硬度,其数值大小与所选用的基本单元有关。用Ca2=作为基本单元与用1/2Ca2=相比较,前者物质的量浓度只有后者的一半。若基本单元选用1/2Ca2+和1/2Mg2+,则在数值上与以往的当量浓度完全相同。至于质量m与质量浓度p,均与基本单元的形式无关,因此,以mgCaCO3/L.和d表示硬度,则不取决于基本单元的选用。
综上所述,基本单元选用当量粒子,例如HCl、NaOH、1/2H2SO4、1/2Ca2+.1/2/Mg2+等等,既符合法定计量单位的使用规则,又保留了当量浓度表示方法的某些优点,而现有图表仍可继续使用,有许多方便之处,在许多场合可得到广泛采用。
硬度单位表示方法及其换算关系见表10-5。
表10-5 硬度表示方法及其换算关系
天然水中的阳离子主要是Ca2+、Mg2+、Na+(包括K+),阴离子主要是HCO3-、SO42-、CI-,其它离子含量均较低。就整个水体来说是电中性的,亦即水中阳离子的电荷总数等于阴离子的电荷总数。实际上,这些离子在水中很难说结合成那些化合物,但是旦把水加热,溶解度变小,便会按一定规律有先有后分别结合成某些化合物从水中沉淀析出。总的说来,钙、镁的重碳酸盐转化成难溶的CaCO3和Mg(OH)2首先沉淀析出,其次是钙、镁的硫酸盐,而钠盐析出最难。在水处瑾中,往往棖据这一现象把有关离子假想地结合一起,写成化合物的形式。若以当量粒子作为基本单元,则水中各种阳离子的物质的量浓度总和应等于各种阴离子的物质的量浓度总和,如表10-6所示。
表10-6 水中离子的理想结合

注:数字表示物质的量浓度,以mmo/L计。
表10-6清晰地表明水中各种离子的假想组合情况以及化合物含量的大小,这样,便子对水质进行分析研究。
目前水的软化处理主要有下亩儿种方法
一是基于溶度积原理,加入某些药剂,把水中钙、镁离子转变成难溶化合物使之沉淀析出,这一方法称为水的药剂软化法或沉淀软化法。
二是基f离子交换原理,利用某些离子交换剂所具有的阳离子(Na'或H)与水中钙、镁离子进行交换反应,达到软化的目的,称为水的离子交换软化法。
此外,还有基于电渗析原理,利用离子交换膜的选择透过性,在外加直流电场作用下,通过离子的迂移,在进行水的局部除盐的同时,达到软化的目的。
本节着重讨论水的离子交换软化法。
有关工业水处理技术的文章

水的软化目的是降低水的硬度。经石灰处理后,水的剩余碳酸盐硬度可降低0.25~0.5mmol/L,剩余碱度约0.8~1.2mmol/L,硅化合物可去除30%~35%,有机物可去除25%,铁残留量约0.1mg/L。阳离子交换树脂可以用于水的软化或脱碱软化,阴、阳离子配合一起则用于水的除盐。离子交换的软化方法目前常用的有Na离子交换法、H离子交换法和H-Na离子交换法等。......
2023-08-30

塑料配方是指在树脂中添加其他各类相关助剂的配比系数。对树脂进行配方设计的目的就是对其原有性能进行改性,以提高其原有性能或获得其原来没有的性能。因为树脂的改性,可获得全新的性能,且远远低于新树脂品种的开发成本。在电器、建筑装饰等应用领域,为使材料具有阻燃性能,就要对其进行阻燃改性,如使原本不具有阻燃性的聚乙烯具有阻燃功能。......
2023-06-26

如图5-22所示,进水也是分成两部分,一部分原水进入H型离子交换器,其出水直接与另一部分原水混合,经H型离子交换器后出水的酸度和原水中的碱度发生中和反应,中和反应所产生的CO2由除碳器去除,再经Na离子交换器,除去未经H型离子交换器的另一部分原水的硬度,其出水即为除硬脱碱了的软化水。......
2023-06-19

学习目标知识目标:掌握设计构成的基本原理,认识形与色的体系,实验构成的思维方法,了解设计构成的学习目的和方法。运用理性分析的方法,即将构成的元素按照美的比例和形态,组合成识别度高、艺术美感强的新形态的设计方法。......
2023-09-27

本章中将联合表观特征、特征点和光流特征进行行为识别,以提高方法的鲁棒性,进一步证明以差分序列为源做行为识别的可行性。在相关工作中,表观特征已经在第6章作了介绍,以下介绍兴趣点和光流计算的研究情况。本章方法的综合过程如图7.1所示。图7.1本章方法行为建模与识别过程示意图本章的方法联合了表观特征和运动特征。与前述工作相比,不同点在于:本章方法中特征来源于差分序列。......
2023-06-16

系统评价目的是为了决策。系统评价是方案选优和系统决策的重要依据,没有正确评价也就不可能有正确决策。具体地说,系统评价具有以下几个目的:1)使评价系统达到最优。评价提供的信息可供决策参考。为使他人对决定的行为能够心悦诚服,便于接受,需对其进行评价。通过对问题分解、分析和评价,获得系统的综合评价。我国自1980年以来,开始重视系统评价研究,对一些重大工程项目进行技术、经济和综合评价。......
2023-07-15

目前,绿色发展已经成为世界潮流、国家的战略。基于以上现实背景,本调查的主要目的是通过对涪陵页岩气开发核心区域——焦石坝地区居民生态环境满意度进行调查,发现存在的问题,为相关决策部门提供第一手的调查资料。了解当地居民对页岩气开发的认识和态度。了解当地页岩气开发过程中的政府与企业环境风险评估、管控、防控措施与机制。......
2023-06-28

(一)施胶的目的纸张纤维之间存在着大量的毛细管,纤维本身又具有亲水性,使纸张具有较强的吸收液体的能力。因此,不同用途的纸或纸板,需要使用与使用过程相适应的检测方法。(六)施胶及施胶剂的发展纸张施胶历史悠久,几乎造纸发明伊始就采用了对纸张进行施胶的方法。......
2023-06-23
相关推荐