长久以来,人们对健康的认识,只停留在不生病的状态就算健康。诸葛亮告诉儿子,对“亚健康状态”这种似健康、非健康,似疾病、非疾病的状态,要熟识它的成因,知道它五花八门的外在表现,使人们在日常生活中能够预防它,增强健康意识。听了诸葛亮的介绍,诸葛方认真地想了想,说:“那么怎样才能避免这种亚健康状态,保持身体的健康呢?”......
2023-12-05
腐蚀的过程本质上是化学过程。以金属腐蚀为例,其腐蚀过程大多为腐蚀原电池的工作过程。
腐蚀原电池工作的基本过程为:
1.阳极溶解过程
金属以离子形式溶解到溶液中,同时电子留在金属上。
以铁的腐蚀为例,阳极溶解的反应为:
![]()
电流在阳极和阴极之间流动是通过电子导体和离子导体实现的,电子通过电子导体即金属从阳极迁移至阴极,溶液中的阳离子从阳极区迁移至阴极区,阴离子从阴极区向阳极区移动。从阳极迁移至阴极的电子被溶液中的氧化剂接受。
2.阴极的反应为
![]()
阴极和阳极的产物发生下列反应:
![]()
如果水中的溶解氧比较充足,Fe(OH)2会进一步氧化,生成黄色的锈FeOOH即Fe2O3·H2O,而不是Fe(OH)3。如果水中的氧不充足,则Fe(OH)2进一步氧化为绿色的水合四氧化三铁或黑色的无水四氧化三铁。
其腐蚀过程如图8-5所示。
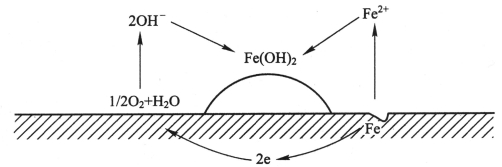
图8-5 铁的腐蚀过程
由此可见,金属的腐蚀实际上就是金属的阳极溶解反应,因此,金属的腐蚀破坏仅出现在腐蚀电池中的阳极区,而腐蚀电池的阴极区是不腐蚀的。就简单的金属腐蚀来说,在金属的表面上同时等速的进行着一个阳极反应和一个阴极反应的现象称为电极反应的耦合。互相耦合的反应称为共轭反应,相应的腐蚀体系称为共轭体系。也就是没有考虑极化时的理想状态,此时金属表面没有电荷的积累,阳极反应释放出的电子恰好为阴极反应所消耗,两极的电极电位也不随时间变化而变化。
由上述可知,只要控制腐蚀过程中阳极反应和阴极反应中任意一个电极反应的速度,另一个电极反应的速度也会随之而受到控制,从而使整个腐蚀过程的速度受到控制。所以可以从以下几个方面控制腐蚀:
1.缓蚀剂法
在腐蚀介质中,加入少量能降低腐蚀速率的物质以防止腐蚀,所加的物质称为缓蚀剂。缓蚀剂主要可分成无机缓蚀剂和有机缓蚀剂两大类。
2.阴极保护法
所谓阴极保护法就是将被保护的金属作为腐蚀电池的阴极即原电池的正极或作为电解池的阴极而不受腐蚀。前者是牺牲阳极保护法,后者是外加电流法。
(1)牺牲阳极保护法即将较活泼的金属或其合金连接在被保护的金属上,使之形成原电池的方法。较活泼金属作为腐蚀电池的阳极而被腐蚀,被保护的金属则得到电子作为阴极而达到保护的目的。一般常用的牺牲阳极材料有铝合金、镁合金和锌合金等。牺牲阳极的表面积与被保护金属的表面积应有适当的比例,通常占被保护金属表面积的1~5%左右。
(2)外加电流法即在直流电源作用下,将被保护金属与另一附加电极形成电解池的方法。被保护金属作为电解池的阴极而达到保护的目的。常使用石墨或废钢作为阳极,阳极属耗材,需定期更换。
有关工业水处理技术的文章

长久以来,人们对健康的认识,只停留在不生病的状态就算健康。诸葛亮告诉儿子,对“亚健康状态”这种似健康、非健康,似疾病、非疾病的状态,要熟识它的成因,知道它五花八门的外在表现,使人们在日常生活中能够预防它,增强健康意识。听了诸葛亮的介绍,诸葛方认真地想了想,说:“那么怎样才能避免这种亚健康状态,保持身体的健康呢?”......
2023-12-05

内部的遗传等因素,外部的疾病、母亲孕期感染、药物注射等因素都会导致听觉障碍。强效抗生素,如链霉素、庆大霉素等药物,无论是孕妇使用还是儿童使用都可能伤害到儿童的听觉神经,因此要尽量避免过多使用抗生素。此外,外伤、噪音等因素也是致聋的重要原因。......
2023-07-02

总的金属腐蚀损失中约有一半以上是大气腐蚀造成的。大气腐蚀属于电化学腐蚀的范畴。潮的大气腐蚀金属在RH<100%的大气中的一种腐蚀,此时水蒸气浓度必须超过某一最小值。湿的大气腐蚀金属在RH接近于100%的大气中进行的一种腐蚀,水分在金属表面上成滴凝聚,水膜厚度在1μm~1mm,属于电化学腐蚀。......
2023-06-23

预防比治疗更重要,主要原则是去除病因和补充适量的微量元素铁。孕期内应定期检测血红蛋白,如果发现贫血及时治疗,以免影响胎儿体内的贮铁量;由于母乳中铁的吸收率高,所以宝宝出生后应尽量采用母乳喂养,喂养时间应该等幼儿主动放弃母乳为止。科学膳食对预防缺铁性贫血是极为重要的。(二)治疗建议缺铁性贫血程度根据血红蛋白值的程度选择治疗方案。......
2023-07-04

儿童常不顾防寒,故患冻疮者常见。本方适应于预防冻疮。适用于治疗冻疮皮肤溃烂。于每年秋季冻疮未出现前,用药酒每日数次涂擦易发生冻疮部位。治疗冻疮204例,结果:服药1个疗程者,痊愈80例,显效120例,无效4例;服药2个疗程者,均痊愈。Ⅱ度冻疮7日判定疗效,Ⅲ度冻疮14日判定疗效。Ⅲ度冻疮41例,治愈37例,占90.24%;无效4例,占9.76%。治疗冻疮126例,治愈102例,好转16例,无效8例,总有效率93.66%。......
2024-01-08

浸泡腐蚀试验也称为全浸腐蚀试验。涂层及其制品有时完全浸没于各种腐蚀性介质的条件下服役,为了试验这种服役环境下涂层的使用性能,试验方法规定了金属覆盖层在各种腐蚀性液体介质中的试验时全浸试验方法,以评定金属覆盖层的全浸腐蚀试验性能。......
2023-06-18

此法用湿膜测厚仪控制漆膜的厚度,测出施工中不同部位的湿膜厚度,可以检查涂装的均匀性;同时能够监督漆膜厚度是否符合规定要求。轮规仪在实验室和现场均适用。除非有特殊要求,涉及涂层外观的光泽、色差、丰满度等指标不作为防腐蚀涂层质量的主要检验项目。......
2023-06-23
相关推荐