局部腐蚀即腐蚀作用仅局限在一定的区域内进行,这类腐蚀通常危险性大。局部腐蚀电池的特征是阴阳极部位是分离的。大多数局部腐蚀是电化学腐蚀,有些局部腐蚀是电化学因素和机械因素共同造成的。最常见的局部腐蚀大致可归纳为三种类型。孔蚀 孔蚀又称为点蚀,是一种高度局部的腐蚀形态。这种腐蚀在低于100℃时,随温度升高而加剧。应力腐蚀破裂能在常用的设计应力范围内发生,因此后果严重。......
2023-06-30
所谓腐蚀就是由于与周围介质相互作用,材料(通常是金属)遭受破坏或材料性能恶化的过程。腐蚀也可以从以下几个方面定义:
1.由于材料与环境反应而引起的材料破坏或变质;
2.除了单纯机械破坏以外的材料的一切破坏;
3.从冶金的角度讲,腐蚀也可视为冶金的逆过程。
腐蚀的分类有多种,一种是将腐蚀分为低温腐蚀和高温腐蚀,另一种是将腐蚀分为化学腐蚀(单纯由直接化合或氧化等化学作用引起的腐蚀,如金属和干燥气体接触时在金属表面上生成相应的化合物)和电化学腐蚀。在给水排水工程中腐蚀通常分为电化学腐蚀和微生物腐蚀两种。
下面主要介绍电化学腐蚀和微生物腐蚀,并对金属与合金的化学腐蚀做简单介绍。
1.电化学腐蚀
电化学腐蚀是很常见的一种腐蚀形式,经过一百多年的研究,人们提出了“腐蚀原电池模型”,腐蚀的过程就是原电池的工作过程。原电池的工作原理如下:
把一片锌片和一片铜片同时放入盛有稀硫酸的容器里,用导线将其连接起来,如图8-1所示。锌将溶于稀硫酸中产生锌离子(即产生了腐蚀现象),所遗留的电子将使锌表面带负电,带负电的表面把带正电的锌离子吸引在附近,形成了双电层。铜片表面同样也出现一个双电层,但由于铜在水中电离的倾向极小,铜片上将吸附水中的铜离子而带正电荷。铜锌分别为正、负极,也是原电池的阴、阳极。原电池就是腐蚀电池,阳极是受到腐蚀的电极,阴极是产生沉淀物的电极。
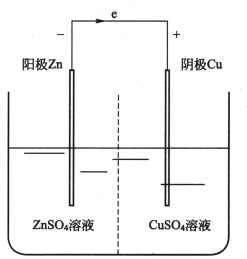
图8-1 腐蚀原电池示意图
电极反应如下:

总反应为
![]()
(1)腐蚀电池的电极
阳极发生的是氧化反应,即被腐蚀的电极,阴极发生的是还原反应。习惯上假定:电流方向为正极到负极,与电子的运动方向相反,因此在原电池中,阳极与负极对应,阴极与正极对应,但是在充电过程中则相反。
①电极电位
上述在阴阳极发生的电极反应导致在金属和溶液的界面上形成双电层,双电层两侧的电位差即为电极电位,也叫绝对电极电位,可以通过测量电池电动势的方法测出其相对电极电位。
②标准电极电位
标准电极电位是指参加电极反应的物质都处于平衡状态(25℃,离子活度为1,分压为1.0×105Pa)时得到的电势。各种金属的标准电极电位可见附录。
(2)极化现象
电化学反应由于受到各种环境因素(物理因素和化学因素)的影响,而产生极化现象,也可以称为一种电化学反应的阻滞现象。所谓极化是指在接通原电池电路后出现电极电势偏离了理论电极电势值的现象。这种电极电势的偏差除了电阻引起的以外就是由于阴阳极的极化引起的。阴阳极的极化包括浓差极化和电化学极化。
①浓差极化浓差极化是由于离子扩散速率缓慢所引起的。在电解过程中,如果离子在电极上放电的速率较快而溶液中离子扩散速率较慢时,电极附近的离子浓度较溶液中其他部分的要小。在阴极上正离子被还原,当正离子浓度减小时,根据能斯特(Nemst)方程式可知,其电极电势代数值将减少;在阳极上负离子被氧化,当负离子浓度减小时,其电极电势代数值增大。总的结果使实际分解电压的数值增大。
②电化学极化电化学极化是由电解产物析出过程中某一步骤(如气泡的形成、原子结合成分子、离子的放电等)反应速率迟缓而引起的电极电势偏离平衡电势的现象。
(3)去极化
所谓去极化是指能消除或抑制原电池阳极或阴极极化的过程。能起到这种作用的物质叫做去极剂,也叫活化剂。
凡是在电极上能吸收电子的还原反应都能起到去极化作用。阴极去极化有如下几种类型:
①阳离子还原反应

②析氢反应
![]()
③阴离子的还原反应
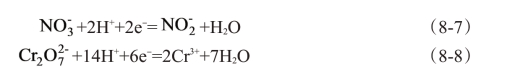
④中性分子的还原反应

⑤不溶性膜或沉积物的还原反应
![]()
在上述各类反应中,最重要最常见的两种阴极去极化反应是氢离子和氧分子阴极还原反应。铁、锌、铝等金属及其合金在稀的还原酸溶液中的腐蚀,其阴极过程主要是氢离子还原反应。锌、铁等金属及其合金在海水、潮湿大气、土壤和中性盐溶液中的腐蚀,其阴极过程主要是氧去极化反应。
(4)伊文思(Evans)极化图及腐蚀图
在研究金属腐蚀时,常用图来分析腐蚀过程和腐蚀速度的相对大小,尤其在分析腐蚀速度的影响因素时,图显得很重要。表示电极电位与极化电流密度或极化电流强度之间关系的曲线称为极化曲线。极化曲线又分为阳极极化曲线和阴极极化曲线。
图8-2为实际极化曲线、图8-3、图8-4为伊文思极化图及腐蚀图。
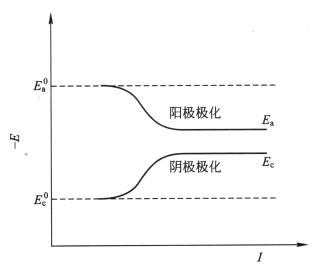
图8-2 电极实际极化曲线

图8-3 伊文思极化图
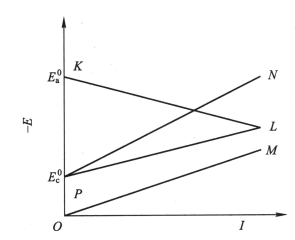
圈8-4伊文思腐蚀图
图中把阴极极化曲线和阳极极化曲线用直线在一张图上简化地表示出来,其中PL是阴极电位降曲线,KL是阳极极化曲线,OM是欧姆电位降曲线,PN是考虑到欧姆电位降和阴极极化电位降的总曲线。伊文思(Evans)极化图中纵坐标代表电极电位E,上端为负,下端为正,所以上端用-E标出;横坐标表示电流强度I。
当电流增加、电极电位移动不大时,表明电极受到的阻碍较小,即电极的极化率较小,极化率即极化曲线的斜率。阳极极化曲线KL代表在电流强度趋于零的时候,电极电位为平衡电位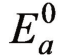 ,随着阳极溶解电流强度的增加,电极电位逐渐向正的方向移动。阴极极化曲线PL则代表阴极还原反应在电流强度趋于零的时候电极电位处于平衡电位
,随着阳极溶解电流强度的增加,电极电位逐渐向正的方向移动。阴极极化曲线PL则代表阴极还原反应在电流强度趋于零的时候电极电位处于平衡电位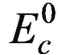 ,随着电流强度的增加,阴极还原电位逐渐向负的方向移动。
,随着电流强度的增加,阴极还原电位逐渐向负的方向移动。
腐蚀极化图是研究电化学腐蚀的重要工具,可以用来确定腐蚀控制因素,也可以用来分析腐蚀过程及影响因素等。
对单纯的金属腐蚀过程来说,阳极和阴极反应是一对共轭反应,阳极反应的速度等于阴极反应的速度,此时的极化电流强度相等,两条极化曲线交于L点,此处对应的电位即为该金属的腐蚀电位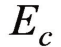 。此时对应的电流密度为腐蚀电流密度
。此时对应的电流密度为腐蚀电流密度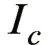 。
。
为消除极化带来的测量误差,准确测定腐蚀电池的电极电位,通常以标准氢电极(SHE)为参比电极,测电极对SHE的相对电位,并假定标准氢电极的电极电位为零,然后用标准氢电极与另一电极组成电解池,即可测得该电极的电极电位。标准氢电极由浸没在氢离子(H+)活度等于1和氢气(H2)压力=1atm=0.101325MPa溶液中带铂黑的铂片组成。
当用氢电极与锌电极组成电池时,发生下列反应:

总反应为
![]()
非标准状态下的电极电位可由能斯特(Nernst)方程得出,即
式中: ——电极还原单位(可参考附录),V;
——电极还原单位(可参考附录),V;
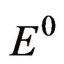 ——标准状态电极还原单位,V;
——标准状态电极还原单位,V;

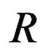 ——气体常数,8.314J(/K·mol);
——气体常数,8.314J(/K·mol);
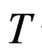 ——绝对温度,K;
——绝对温度,K;
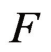 ——法拉第常数,96485C/mol;
——法拉第常数,96485C/mol;
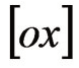 —氧化型;
—氧化型;
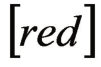 —还原型。
—还原型。
当25℃和其他常数代入并改用普通对数时,上式简化成

(5)钝化现象。
另外跟电化学腐蚀相关的还有一种现象,即金属的钝化现象,其定义为某些金属或合金在特殊环境条件下失去了化学活性,由活化态转为钝态,金属或合金钝化后具有的耐蚀性称为钝性。
引起金属钝化的因素有化学及电化学两种。化学因素引起的钝化,一般是由强氧化剂引起的,如硝酸、硝酸银、氯酸、氯酸钾、重铬酸钾以及等,另外有些非氧化性酸也能使金属钝化,如Mg在HF中的钝化,Fe在0.5mol/L的H2SO4溶液中,外加电流引起的钝化。钝化现象是金属活化极化的一种特殊情况,由于生成了表面膜或保护隔离层,金属在很大的氧化能力范围内是稳定的,在极强的氧化条件下,这类金属又失去了耐腐蚀性能。这种性质也被用来发展新的防腐方法。
多数钝化膜是由金属氧化物组成的。在一定条件下,铬酸盐、磷酸盐、硅酸盐及难溶的硫酸盐和氯化物也能构成成相膜。钝化膜与溶液的pH、电极电位及阴离子性质、浓度有关。
人们普遍接受的钝化理论有两种:
①成相膜理论
该理论认为钝化金属的表面存在一层非常薄、致密且覆盖性能良好的三维固态产物膜。这种膜形成的独立相(成相膜)的厚度为1~10nm之间。这些固相产物大多数为金属氧化物。此外,磷酸盐、铬酸盐、硅酸盐以及难溶的硫酸盐、卤化物等在一定条件下也可构成钝化膜。
②吸附理论
吸附理论认为,金属钝化并不需要生成成相的固态产物膜。只要在金属表面或部分表面上形成氧或含氧粒子的吸附层就够了,这种吸附层只有单分子层厚,可以是原子或分子态氧,可以是OH-或O-。吸附层对金属或合金的活性阻滞有以下几种观点:
A.吸附氧饱和了表面金属的化学亲和力,使金属原子不再从晶格上移出,造成金属钝化;
B.含氧吸附层粒子占据了金属表面的反应活性点,如边缘等易于反应处,从而阻滞了金属的反应溶解;
C.吸附改变了金属和电解质溶液之间的界面双电层结构,使金属阳极反应的活化能显著升高,从而降低了金属或合金的活性。
两种钝化理论在某种程度上都可以解释一些事实,都认为是在金属表面上形成了一层膜从而阻滞了金属或合金的溶解。区别在于成膜原因,吸附理论认为形成单分子层的二维吸附层导致钝化;成相膜理论认为要形成几个分子层厚的三维膜才能保护金属。实际上,金属在钝化过程中,在不同条件下,这两种理论可能分别起主导作用。
2.微生物腐蚀
微生物腐蚀是由于微生物的生命活动直接或间接地对材料产生了腐蚀,这类微生物包括细菌也包括较大的藻类和原生动物。微生物腐蚀的本质原因是微生物参与了引起腐蚀的电化学反应。常见的如化工厂等的冷却水循环系统、热交换系统、污水处理管道、给水管道、热交换系统等都有微生物污染及腐蚀发生,腐蚀的材料也涉及金属和非金属。微生物对除钛合金之外的所有金属材料均有腐蚀。
生物是靠化学反应维持生存的,生物在代谢过程中会有以下几方面影响腐蚀:
(1)直接影响阳极和阴极的反应;
(2)影响表面保护膜;
(3)形成腐蚀条件;
(4)产生沉积物。
这些影响可以单独或同时存在,具体随环境和生物的种类不同而不同。
微生物按照在有氧或无氧条件下生存的能力而分类,需要氧才能进行代谢的生物称为好氧性细菌,反之,在缺氧或无氧环境中进行代谢的称为厌氧性细菌。
厌氧腐蚀是在厌氧条件下,一些厌氧菌利用氧化还原反应产生的能量进行生长,在此过程中使材料发生腐蚀。厌氧腐蚀的最典型例子是硫酸盐还原菌的腐蚀作用。硫酸盐还原菌的腐蚀过程如下:
阳极反应:
![]()
阴极反应:
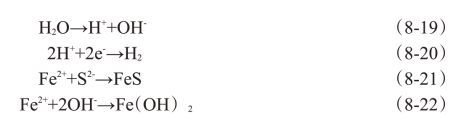
硫酸盐还原反应中,六价的硫还原为两价的硫,在还原过程中起了去极化的作用,细菌得到能量。腐蚀的生成物为FeS和Fe(OH)2。
当水中有CO2时,S2-和Fe的反应如下:

整个反应过程由阴极去极化驱动,限制反应的因素是阴极上氢的消耗速度。由于甲烷菌、硫酸盐还原菌和乙酸菌在代谢过程中都需要氢进行代谢,这些菌在材料表面的生长在消耗电化学产生氢的同时对材料的腐蚀也起了促进作用。
由好氧菌引起的腐蚀,表现形式有两种:一是造成氧差电池引起的腐蚀。微生物附着处的氧相对缺乏而形成阳极,附近的表面上氧相对高的为阴极。电化学反应的结果是,金属在阳极溶解,电子迁移到阴极处与氧结合形成金属的氧化物及水化物。二是利用代谢产物引起的腐蚀。硫氧化菌能氧化元素硫、硫代硫酸盐、亚硫酸盐等,产生代谢产物硫酸,其腐蚀过程(以硫氧化菌为例)可以表示为:
![]()
硫酸离解:

金属阳极反应:
![]()
在酸性条件下,阴极氢还原:
![]()
在中性或微碱性下,氧还原:
![]()
腐蚀产物分别为:

微生物还可以对无机材料起到破坏的作用。硫酸盐还原菌释放的硫化氢被氧化成硫酸后对无机材料也可以产生腐蚀。另外真菌分泌的有机酸和微生物体外的多聚物都对水泥产生腐蚀作用。硫酸盐还原菌、硫氧化菌和硝化菌都会对无机材料造成腐蚀。
此外,硫酸盐还原菌和硫氧化菌可以循环发生作用。当雨季土壤潮湿并缺氧时,硫酸盐还原菌迅速生长,当干季空气渗透到土壤时,硫氧化菌又迅速生长。在一些地区,这种循环作用引起埋在地下的管线严重腐蚀。另外铁细菌能从水中吸收亚铁离子,将氢氧化铁或氢氧化亚铁沉淀细胞壁附近,使钢表面产生结瘤,引起缝隙腐蚀。另外多数细菌产生二氧化碳,生成碳酸,也会使腐蚀性增强。
防止微生物腐蚀有几种方法。对埋在地下的结构常用沥青、磁漆、塑料带或混凝土覆盖以防止钢结构与环境接触。此外,阴极保护用来防止微生物腐蚀,还可以与涂层联用。在循环体系中加入缓蚀剂及杀生剂也可以抑制微生物腐蚀。
另外诸如真菌、霉菌、水生物也可以引起腐蚀。这类生物吸收有机物并产生一定量的有机酸,对材料进行破坏。
3.化学腐蚀
通常金属相对于其周围的气体是热不稳定的,根据气体成分和反应条件不同,将生成氧化物、硫化物、碳化物及氮化物等,或者生成这些产物的混合物。在室温时,金属或合金的这种不稳定性不严重,因为反应速度比较低。但是随着温度的升高,反应速度加快,金属与环境介质中的气相或凝聚相物质发生化学反应而遭到破坏,这就是所谓的高温氧化,也称为高温腐蚀。在给水排水工程中这种情况不多见,而常见于化工、冶金、核反应堆及航空等领域。高温腐蚀的危害很严重,除了损坏金属,造成金属性能下降外,还会导致发生严重的事故。
有关工业水处理技术的文章

局部腐蚀即腐蚀作用仅局限在一定的区域内进行,这类腐蚀通常危险性大。局部腐蚀电池的特征是阴阳极部位是分离的。大多数局部腐蚀是电化学腐蚀,有些局部腐蚀是电化学因素和机械因素共同造成的。最常见的局部腐蚀大致可归纳为三种类型。孔蚀 孔蚀又称为点蚀,是一种高度局部的腐蚀形态。这种腐蚀在低于100℃时,随温度升高而加剧。应力腐蚀破裂能在常用的设计应力范围内发生,因此后果严重。......
2023-06-30

杂散电流腐蚀和接触腐蚀都是由电学因素促进的。图1-24腐蚀的分类根据腐蚀的形态可以将腐蚀分为均匀腐蚀和局部腐蚀。均匀腐蚀也称全面腐蚀,结果是使金属变薄,最终结果是使结构穿孔或发生类似于超载引起的破坏。局部腐蚀造成的金属损失量并不大,但往往造成巨大的经济损失和灾难性事故。有调查结果表明,腐蚀破坏事故中,局部腐蚀所占的比例高达80%以上,必须予以高度的重视。......
2023-06-23

轴承是当代机械设备中一种举足轻重的零部件。按运动元件摩擦性质的不同,轴承可分为滚动轴承和滑动轴承两类。图2-37滑动轴承部分式滑动轴承示意图 1—轴承座;2—轴承盖;3—对开轴身;4—双头螺柱 滑动轴承实体图滑动轴承按承载方式分为向心轴承及推力轴承;按润滑状态分为流体润滑轴承、非流体润滑轴承、无润滑轴承。......
2023-06-23

防腐蚀涂料品种繁多,目前性能较好的防腐蚀涂料大多采用氯化橡胶作为基础成膜物质。由于氯化橡胶分子结构规整、饱和、极性小、化学稳定性好,用它制备的各种防腐蚀涂料具有涂膜干燥快、附着力好、耐化学腐蚀和抗潮湿渗透性优良等特性。用高氯化聚乙烯树脂代替氯化橡胶制备防腐蚀涂料,可获得与氯化橡胶防腐漆性能相似的防腐蚀涂层。这些特点都决定了高氯化聚乙烯树脂很适合于配制现场修复用的防腐蚀涂料。......
2023-06-23

搜集资料是进行市场研究的基础和核心工作,二手数据的搜集是工作的第一步。(三)按照调查组织方式进行分类按照调查组织方式分为统计报表制度和专门调查。统计报表制度是按照国家统一规定的调查要求与文件自上而下地提供统计资料的一种报表制度。专门调查是为研究某种情况或问题专门组织的统计调查,包括普查、抽样调查和典型调查等。直接观察法是对调查对象进行直接点数与计量,如商品库存盘点。......
2023-08-13

保持架的作用是将滚动体均匀隔开,以减少滚动体之间的摩擦和磨损。2)对于承受径向载荷和承受轴向载荷的场合,应根据不同的情况来选用轴承类型。当轴向载荷比径向载荷小得多时,可选用深沟球轴承。......
2023-06-25

常见燃气炉的炉型和应用范围见表10-5。砌体是承受载荷的主要结构部分,根据炉墙、炉底、炉顶的结构形式来确定耐火材料与绝缘物质,炉膛、排气烟道的设计应合理。通常将其布置在炉顶、炉底、燃烧的对方炉膛和同方向一侧。排烟口位置的选择应遵循使高温炉气包围零件,对流和辐射传热效果增强,炉底不会有冷气层等原则。......
2023-08-18

现代保险业务的框架是由财产保险、人身保险、责任保险、信用保证保险四大部分构成的。广义的财产保险包括财产损失保险、责任保险、信用保证保险等;狭义的财产保险是以有形的物质财富及其相关利益为保险标的的一种保险。......
2023-08-10
相关推荐