压力钢管内外壁维护良好,定期进行防腐处理;焊缝无开裂,伸缩节完好,无渗漏。注册登记受理机构认可后,即应发给相应的登记表,由大坝管理单位认真填写,经所管辖水库大坝的主管部门审查后上报。经审查核实,注册登记受理机构应向大坝管理单位发给注册登记证。......
2023-06-27
能够让溶液中一种或几种组分通过而其他组分不能通过的这种选择性膜称半透膜。用一选择性透过溶剂水的半透膜将纯水和咸水隔开,开始时两边液面等高,即两边等压、等温,则水分子将从纯水一侧通过膜向咸水一侧自发流动,结果使咸水一侧的液面上升,直至到达某一高度,这一现象称为渗透,如图6-10(a)所示。
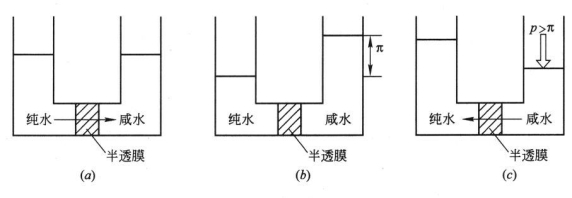
图6-10 渗透与反渗透现象
(a)渗透;(6)渗透平衡;(c)反渗透
渗透的自发过程可由热力学原理解释,即:
![]()
式中:μ——在指定的温度、压力下咸水的化学位;
μ0——在指定的温度、压力下纯水的化学位;
x——咸水中水的摩尔分数;
R——气体常数,等于8.314J/(mol·K);
T——热力学温度,K。
由于x<1,Inx为负值,故μ0>μ,亦即纯水的化学位高于咸入水中水的化学位,所以水分子便向化学位低的一侧渗透。由此可知,水的化学位的大小决定着质量的传递方向。
当两边的化学位相等时,渗透即达到动态平衡状态,水不再流咸水一侧,这时半透膜两侧存在着一定的水位差或压力差,如图6-10(b)所示,此即为在指定温度下的溶液(咸水)渗透压π。渗透压是溶液的一个性质,与膜无关,可由修正的Van,t Hoff方程式进行计算:
![]()
式中:c——溶液浓度,mol/m3;
π——溶液渗透压,Pa;
i——校正系数,对于海水,i约等于1.8。
例如,含盐量为,34.3‰的海水,浓度等于0.56×103mol/m3,其渗透压(25℃)为:
π=icRT=1.8~0.56×103×8.314×298=2.5×106Pa=2.5MPa.
当在咸水一侧施加的压力P大于该溶液的自然渗透压π时,如图6-10(c)所示,可迫使水反向渗透,此时,在高于渗透压的压力作用下,水压克服了化学位差,即渗透压,水分子从咸水一侧反向地通过膜透过到纯水一侧,此即反渗透。由此可知,发生反渗透的两个必要条件是:(1)选择性透过溶剂的膜;(2)膜两边的静压差必须大手其渗透压差。在实际的反渗透过程中膜两边的静压差还要克服透过膜的阻力。因此,在实际应用中需要的压力比理论值大得多。将半透膜用于海水淡化就是基于反渗透原理。
有关工业水处理技术的文章

压力钢管内外壁维护良好,定期进行防腐处理;焊缝无开裂,伸缩节完好,无渗漏。注册登记受理机构认可后,即应发给相应的登记表,由大坝管理单位认真填写,经所管辖水库大坝的主管部门审查后上报。经审查核实,注册登记受理机构应向大坝管理单位发给注册登记证。......
2023-06-27

根据此特性,使用万用表分别对复合式开关进行检测。图4-11所示为按下开关时复合按动式开关的常开触头阻值的检测演示。图4-11 按下开关时复合按动式开关的常开触头阻值的检测图解演示若检测结果不正常,说明该复合开关已损坏,可将复合开关拆开,检查内部的部件是否有损坏,若部件有维修的可能,将损坏的部件代换即可;若损坏比较严重,则需要将复合开关直接更换。......
2023-06-24

(同上)此亦一隐者,谓孔子不为其已。(《神仙传》以接舆姓陆名通,隐峨眉山。其说晚出,不足深据。其于隐者,睠怀独深。此二章盖孔子遇隐之后,因尚论古之隐者而致其意。况齐、蔡诸地本是旧名,在商时已有之,周但因其地而封国焉耳。孔子对于古今隐者,本在心许之列。独郑玄以七字为十字之误:伯夷、叔齐、虞仲,避世者;荷蓧、长沮......
2023-11-21

为保证异重流运动相似,张俊华等、李书霞等 以非恒定异重流运动方程式开展相似分析,并通过水库泥沙模型检验,得出的异重流发生相似条件,利用二维非恒定非均匀流的扩散方程得到异重流挟沙相似条件及异重流连续相似条件分别为:上述公式构成了完整的河道及水库模型相似律。上述公式构成了完整的河道及水库模型相似律。......
2023-06-23

研究工时消耗的目的,就在于编制或测定定额时,要充分考虑到哪些工作时间消耗是必需的,哪些工作时间消耗是不必的,以便于分析、研究各种影响因素,减少和消除工作损失,以提高劳动生产率。......
2023-06-23

Zn是普通黄铜中的易损耗元素,配料时应进行适当的预补偿。黄铜在熔炼后期会沸腾,这也是一个必不可少的工艺过程。表4-23列举了一些普通黄铜的熔炼技术条件和操作要点。复杂黄铜的出炉时机同样可以通过观察“喷火”来判断,表4-24列举了一些复杂黄铜的出炉温度,以及熔炼时需要的覆盖剂和脱氧剂......
2023-06-22

小批生产的工艺特征接近单件生产,常将两者合称为单件小批量生产。大批生产的工艺特征接近于大量生产,常合称为大批大量生产。大量生产是指同一产品的生产数量很大,通常是一工作地长期进行同一种零件的某一道工序的加工。按年生产纲领划分生产类型,见表4-1。......
2023-06-29
相关推荐