当溶液中存在两种或两种以上的溶质并用活性炭来吸附时,将会产生非常复杂的竞争吸附现象。常用的两组分竞争吸附模型来自于对Freundlich吸附等温式修正的理想溶液吸附理论。......
2023-06-19
一种吸附剂的重要特性就是它所能吸附的吸附质的量。影响吸附剂吸附量的主要因素包括溶液浓度和温度。通常研究的是在恒温及吸附平衡状况下,单位吸附剂的吸附容量qe和平衡溶液浓度Ce之间的关系曲线,称为吸附等温线。常见的几种吸附等温线如图4-1所示。对吸附等温线的描述有几种模型,这里介绍两个比较常用的模型,即Freundlich吸附等温式和Langmuir吸附等温式。
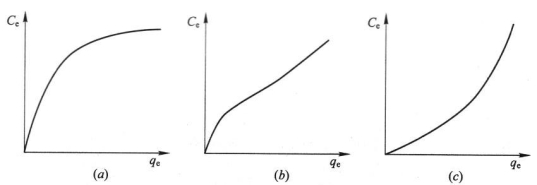
图4-1 几类常见等温吸附线
1.Freundlich吸附等温式
Freundlich吸附等温式是一个经验公式,它能较准确描述大多数吸附数据。该吸附等温式的表达形式为:
![]()

式中:qe——饱和吸附容量,单位为吸附质的质量/吸附剂质量(mg/g),或吸附质摩尔数/吸附剂质量(mmo1/g);
Ce——溶液平衡浓度,单位为吸附质质量/体积(mg/L),或吸附质摩尔数/体积(mmo1/L)。
K和1/n是一个特定体系的常数,1/n无量纲,K的单位由qe和Ce的单位确定。
尽管Freundlich吸附等温式是一个用来解释经验数据的公式,但后来Halsey和Taylor(1947)发展的吸附理论可以推导出Freundlich吸附等温式。
参数K主要与吸附剂对吸附质的吸附容量有关,而1/n是吸附力的函数。对于确定的Ce和1/n,K值越大吸附容量qe越大。对于确定的K和Ce,1/n值越小吸附作用越强。当1/n值很小时,吸附容量几乎与Ce无关,吸附等温线逼近水平线,这时qe几乎为常数。如果1/n值大,则吸附作用力弱。qe随着Ce的微小改变而产生明显的改变。尽管Freundlich吸附等温式能够有效地处理大部分吸附数据,但是仍有许多不适用的情况。
通常某一种吸附剂对一种吸附质的吸附常数K以及1/n可以通过实验确定。由式(4-3)所示,对于一系列的吸附容量qe和平衡溶液浓度Ce取对数所得到的lgCe和lgqe为线性关系,其斜率和截距分别为1/n和K。
2.Langmuir吸附等温式
Langmuir吸附等温式是一个理论公式,形式如下:

式中b和qmax是常数,qe和Ce分别为饱和吸附量和溶液的平衡浓度。常数qmax与表面吸附的单分子表层浓度有关,且代表了当Ce增加时qe的最大值。常数b与表面吸附能量有关,当吸附力增大时b值也增加。
该理论模型认为,吸附质在均匀固体表面形成单分子层的吸附层,吸附在固体表面的分子之间不存在作用力,吸附为动态平衡:
![]()
设θ为某一平衡时刻吸附剂(如活性炭)表面被覆盖的百分比,A为总吸附位置数量。若吸附剂表面均匀,则被占用的吸附位置为Aθ,空余的吸附位置为A(1-θ)。由于被吸附的分子之间不存在作用力,那么吸附速度V1与吸附质的浓度及附空位成正比,脱附速度V2与吸附表面吸附质浓度成正比,即存在如下两式:

同时,由于吸附达到平衡状态时:
![]()
联立(4-6)和(4-7)两式,则有:

其中b=k1/k2。
设表面最大吸附量为qmax,平衡时的吸附量为qe,由吸附量及吸附位对应关系得:

将式(4-9)代入式(4-8)得式(4-4)。
在式(4-4)中,qmax和b为对应于某一吸附过程的常数,这两个吸附常数的确定方式可以先将式(4-4)变形得到:
![]()
在通过试验获得一系列qe和Ce数据的前提下,可以通过数学方法求得qmax和b。
有关工业水处理技术的文章

当溶液中存在两种或两种以上的溶质并用活性炭来吸附时,将会产生非常复杂的竞争吸附现象。常用的两组分竞争吸附模型来自于对Freundlich吸附等温式修正的理想溶液吸附理论。......
2023-06-19

吸附等温线测量方法根据测定样品吸附气体量多少方法的不同,可分为:连续流动法、容量法及重量法,重量法现在基本上很少采用;根据计算比表面积理论方法不同可分为:直接对比法比表面积分析测定、Langmuir法比表面积分析测定和BET法比表面积分析测定等。在相同的吸附和脱附条件下,被测样品和标准样品的比表面积正比于其脱附峰面积大小。由于BET法具有更可靠的理论依据,目前国内外更普遍认可BET法比表面积测定。......
2023-06-20

据此得到实验条件下泥沙吸附磷的Langmuir等温式(图2),该等温式表示处于吸附平衡状态的水沙体系中,单位质量泥沙吸附量与水体溶解磷浓度的关系。本次实验结果表明,泥沙吸附磷反应的可逆性低,不同泥沙含量对应不同的吸附等温式。图3反映含沙量影响的Langmuir吸附等温式计算值与实验测定值的比较......
2023-06-26

其中,介孔材料的比表面积可高达1 000 m3/g。根据曲线的线型,可将吸附等温线分为六种类型,如图9-5所示。等温线的第一个陡峭位置表示单分子层饱和吸附量。图9-5吸附等温线类型图9-5为类型Ⅲ的等温线呈凹形,未出现类型Ⅱ中的陡峭位置,表示吸附剂与吸附质之间的相互作用很弱。这是因为吸附是有孔壁的多分子层吸附和孔中凝聚两种因素产生,而脱附仅由毛细管凝聚引起。......
2023-06-20

光子的动量与其圆频率ω呈线性关系。继而利用光的波粒二象性中的电磁波函数导出式:E=e·eiθ。按照现代光学波粒二象性理论[11],同一时刻在同一地点出现的同一个频率的光子数的概率振幅,等效于同一频率的复振幅。这里另辟蹊径,用的数学模型仅仅抓住了光色的矢量特征,在复频谱上模拟了光与色的映射关系。......
2023-11-18

这些因素包括:1.时间点冲突开始发生时刻的标志。对于建模而言,则是能够得到有用信息的终点。在冲突模型中,这些具有独立决策权的参与者被称为决策人,或局中人。我们称只含有两个决策人的冲突模型为“二人对策”,而多于两个决策者的冲突为“多人对策”。偏好函数在冲突分析中起着非常重要的作用,也是模型化过程中最重要的一步。......
2023-07-15

由于内燃机的燃烧过程受到湍流运动的影响,因此燃烧模型的选择必须考虑湍流对火焰面的扰动、扭曲及对火焰传播速度的加速作用,即要充分考虑火焰传播与湍流运动的耦合作用。将良好尺度中的燃烧视为发生在定压反应器中,初始条件取为单元内当前的物质和温度。EDC燃烧模型在湍流反应流动中能耦合详细的化学反应机理,但是计算开销很大。......
2023-06-23

选中的应急服务设施点的6个地点为马尔康、阿坝、若尔盖、壤塘、茂县和九寨沟与不考虑配送时序特征和仓库容量的布局模型的优化结果有所变动。可见当考虑存在多类需求且各类需求具有明显时序特征时,会对选址结果产生影响。可见,对比不考虑时序特征的布局优化模型,计算规模大大增加,程序运行耗时增长。程序运行超过1小时后依旧未找到全局最优解。......
2023-09-19
相关推荐