地壳中铁的平均含量不高,铁元素必须得在某些地方集中起来,才能形成铁矿。铁矿还有些铁矿是岩浆活动造成的。岩浆在地下或地面附近冷却凝结时,可以分离出铁矿物,并在一定的部位集中起来;岩浆与周围岩石接触时,在条件合适的时候,也可以相互作用,发生变化,形成铁矿。......
2023-11-22
我国含铁的地下水分布颇广,一般含铁量在4~30mg/L左右。含铁地下水由于在地下,铁是以Fe2+状态存在。这种水刚抽到地面时,水质清澈干净,但有铁腥味;时间略长,水质即发浑,洗涤织物及器具时会留下锈色斑点。Fe2+离子极易污染离子交换树脂,使树脂中毒而降低交换能力。当用含铁水作锅炉补给水时,容易在锅炉受热面上结成铁垢,不仅影响传热,还易引起管壁腐蚀。冷却水中铁含量超过0.5mg/L时,会促使铁细菌繁殖,产生的粘泥除会堵塞管路外,还会加速换热设备的腐蚀。因此,除铁要引起足够的重视。
常用的除铁方法是曝气除铁和锰砂过滤除铁。
1.曝气除铁法
Fe2+极易被氧气、氯气、高锰酸钾等氧化剂氧化成Fe3+。地下水中Fe2+常以Fe(HCO3)2化合物存在。当水提到地面遇到空气中的氧时,Fe2+即被氧化成Fe3+,形成难溶的红棕色Fe(OH)3沉淀。因此,可利用空气中氧气使水中Fe2+氧化成Fe3+,形成Fe(OH)3沉淀达到除铁的目的。这个过程称为曝气除铁,其反应如下
![]()
曝气后的水再经过滤处理即可除去Fe(OH)3沉淀物。
曝气氧化法出铁一般适用于水中含铁浓度在5~10mg/L,pH值在6.5~7.0范围内。处理后水中含铁可降至0.3mg/L以下。
常用的曝气装置有莲蓬头曝气装置和跌水曝气装置。图2-1为莲蓬头曝气装置。

图2-1 莲蓬头曝气除铁装置
莲蓬头曝气装置一般直接置于重力式过滤池的上面,使喷头淋水量与过滤池出水量保持相等即可。当原水中Fe2+含量小于5mg/L时,喷头距水面高1.5m即可;当Fe2+含量大于10mg/L时,高度为2.5m较好。喷头直径为150~300mm,喷头上孔眼直径为3~6mm。这种装置结构简单、操作方便;但喷淋时水易散失,喷头孔眼易被铁的沉积物堵塞,影响喷水效果。
另一种装置为跌水曝气。如图2-2所示。将地下水提至地面后经溢流堰或者水管,自高处自由下落,使水流变薄变细。水在下落过程中,可与空气充分接触,达到曝气目的。
通常可将重力式无阀滤池的跌水装置的高度适当增加即可。跌水高度一般在0.5~1.0m时,即可满足含铁量在5~10mg/L的地下水除铁的要求。如原水pH值低于6.5以下,这种装置除铁效果较差,因在曝气过程中,空气中O2可充分溶入水中,但水中CO2不易逸出,原水pH值提高有限。在低pH值下,不利于除铁反应的进行。也可设置一个小型的跌水曝气水池,再将曝气后的水经过机械压力过滤器进行过滤净化。
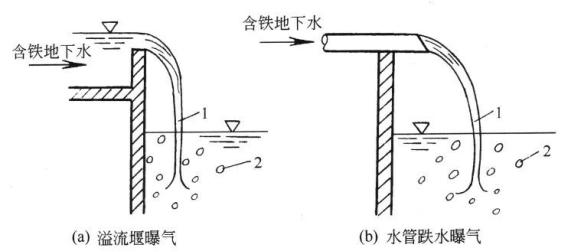
图2-2 跌水曝气示意图
1—水舌;2—空气泡
2.锰砂过滤除铁法
天然锰砂中含有MnO2,它是将Fe2+氧化成Fe3+的良好催化剂,其催化反应为
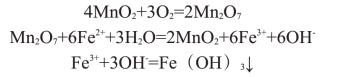
Fe(OH)3气沉淀物经锰砂层过滤后除去。因此,锰砂既是催化剂又是滤料。
锰砂过滤除铁反应中,仍要求水中有足够的溶解O2。因此,锰砂过滤除铁装置往往是将曝气装置和锰砂过滤器结合在一起组成。图2-3所示为在锰砂为滤料的压力式过滤器前加一个气水混合装置,使原水先进行曝气充氧,再经锰砂过滤器催化后再净化。图2-4为气水混合器示意图。
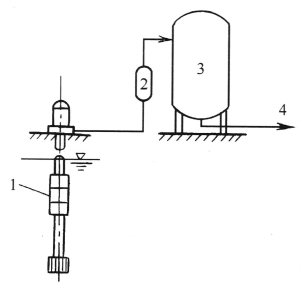
图2-3 气水混合器曝气除铁系统
1—水泵;2—气水混合器;3—锰砂过滤器;4—清水
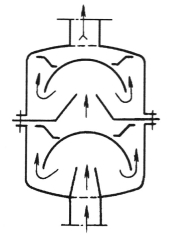
图2-4 气水混合器示意图
此外还有选用水射流泵亦称加气阀,通过高速水流在加气阀中形成的真空将空气吸入,与原水充分混合曝气后,再进入锰砂过滤器进行催化、净化。图2-5及图2-6分别为加气阀曝气除铁系统和加气阀结构图。
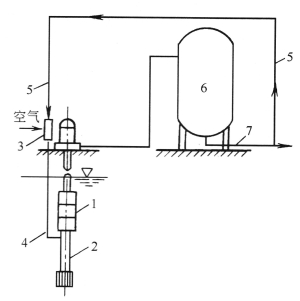
图2-5 加气阀曝气除铁系统
1—水泵;2—吸水管;3—加气阀;4—空气混合水;5—除铁水;6—锰砂过滤器;7—清水
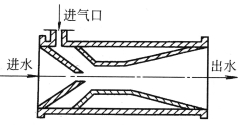
图2-6 加气阀结构图
锰砂除铁一般适合于地下水含铁量小于20mg/L的除铁。
有关工业水处理技术的文章

地壳中铁的平均含量不高,铁元素必须得在某些地方集中起来,才能形成铁矿。铁矿还有些铁矿是岩浆活动造成的。岩浆在地下或地面附近冷却凝结时,可以分离出铁矿物,并在一定的部位集中起来;岩浆与周围岩石接触时,在条件合适的时候,也可以相互作用,发生变化,形成铁矿。......
2023-11-22

感应炉铁液过热的目的是消除生铁的遗传性,净化铁液,便于除渣。感应炉的最高温度为1600℃左右,不及冲天炉,在使用增碳剂时,难以高度溶解分散,结晶时易形成片块状石墨;铁液的过热时间长达1h,又有电磁搅拌,可作为共晶结晶的外来晶核因溶解反应而大量减少。必须使用洁净无锈的炉料,配料的成分应满足铁液成分的要求,而不能期望通过熔炼达到铁液的成分。通常感应炉原生铁用量在10%左右,超过20%,铸铁的力学性能将难以保证。......
2023-06-24

在冰箱中贮存时间较长的菜容易发蔫,可在清水中滴三五滴食醋,将菜泡五六分钟后再洗净、这样可使蔬菜回鲜,下面小编介绍如何去除各类蔬菜残留农药。用清水冲洗蔬菜清洗蔬果最好用流动的清水冲洗,借用水的稀释及清洗能力,可以去除掉大部分残留在蔬果表面上的农药。加盐去菜虫洗菜时,取适量食盐撒在清水中,反复揉洗后,即可清除蔬菜里的虫子。......
2024-01-19

纯乙酰二茂铁为橙黄色固体,熔点84~85℃。[1]酰化时由于催化剂和反应条件不同,可得到一乙酰二茂铁或1, 1′-二乙酰基二茂铁。二茂铁酰化形成二乙酰基二茂铁时,第二个酰基为什么不能进入第一个酰基所在的环上?为什么合成二乙酰基二茂铁时需要装置干燥管?......
2023-06-15

采用耐腐蚀铬镍高合金堆焊的容器、管道及机器零件,多数要求母材与堆焊金属的熔合区具有较高的韧性,即不允许或限制马氏体组织的出现,以减小脆性和焊接裂纹的敏感性。此外还要求用最少的堆焊层数,得到表层具有符合要求的铬镍合金成分和所要求的有效耐蚀层厚度。焊条、焊剂按规定预热,堆焊后一般不进行热处理。......
2023-06-23

表2-52 每100kg金属炉料的焦炭用量初选值范围2.4.4.2 层铁量初选为了减少冲天炉运行底焦高度的波动,应尽量减少层铁量。层铁量可根据冲天炉的熔化率和加料批次,按照下式计算并对计算值进行适当圆整。表2-53 常用冲天炉的层铁量范围2.4.4.3 层焦量的初选层焦量可以按照冲天炉的铁焦比和层铁量初步确定。......
2023-06-24

铁碳相图表示了钢的成分、内部组织与温度三者之间的相互关系。合金中具有同一化学成分且结构相同的均匀部分称为相。但合金溶液经冷却结晶后,由于各组元之间相互作用不同,固态合金中将形成不同的相结构,合金的相结构可分为固溶体和金属化合物两大类。它们的断口有白亮光辉,故称为白口铸铁。表4-10 铁碳合金的基本组织和铁碳相图中各相特征注:名称栏中某氏体,除珠光体外,都是以发现者的名字命名的。......
2023-06-26
相关推荐