实验二基因工程干扰素效价的测定1.实验目的掌握干扰素的效价测定方法。分子生物学及基因工程技术的发展为大量生产细胞因子类药物提供了条件,而对于基因工程生产的干扰素,需要进行干扰素效价的测定。本实验采用细胞病变抑制法进行干扰素效价的测定。常用于测定干扰素效价的细胞为人二倍体细胞株,如人胚肌皮细胞次代培养物、人羊膜细胞Wish、FL及人喉癌细胞Hep-2均可。基因工程干扰素样品96孔培养板、Tip。......
2023-12-07
实验三 青霉素效价的测定
1.实验目的
了解用杯碟法测定抗生素效价的原理,掌握青霉素效价生物测定的具体操作步骤与方法。
2.实验原理
抗生素的效价测定法有:液体稀释法、比浊法和扩散法等。本实验采用国际上最常用的杯碟扩散法来测定青霉素的效价。将规格完全一致的牛津小杯(即不锈钢小管)置于含敏感菌的琼脂平板上,在牛津小杯中加入已知浓度的标准青霉素溶液和未知浓度的青霉素发酵液,抗生素会自牛津小杯处向平板四周扩散,在抑菌浓度所达范围内敏感菌的生长被抑制而出现抑菌圈。在一定的范围内,抗生素浓度的对数值与抑菌圈直径呈线性关系。因此,只要将被测样品与标准品的抑菌圈直径进行比较,就可在标准曲线上查得未知样品的抗生素效价值。
3.实验试剂及材料
(1)0.2mol/L磷酸缓冲液(pH=6):K2HPO40.2g(或K2HPO4·3H2O0.253g),KH2PO4 0.8g,蒸馏水100ml。
(2)0.85%Nacl生理盐水溶液。
(3)苄青霉素钠盐:1.667U/mg(1U即1国际单位,等于0.6μg)。
(4)菌种:金黄色葡萄球菌(Staphylococcus),产黄青霉(Penicilliumchrysogenum)。
(5)培养基:牛肉膏蛋白胨琼脂培养基,作生物测定时,平板分上下两层,上层需另加0.5%葡萄糖。
(6)牛津小杯[内径(6+0.1)mm,外径(8+0.1)mm,高(10+0.1)mm],培养皿(直径90mm,深20mm;大小一致,皿底平坦),滴管、移液管等。
4.实验步骤
(1)制备敏感菌悬液
①传代与保存:将测定用的金黄色葡萄球菌在新鲜斜面培养基上传代,每隔3周传代一次,在37℃恒温箱内培养18~20小时后,再于室温下放置3~4小时,使菌种斜面产生良好的色素,然后将其置于4℃冰箱保存。
②活化:使用前先将供试菌株在斜面培养基上连续传代3~4次,使菌种充分恢复其生理性状。
③制备悬液:将活化的敏感菌斜面,用0.85%生理盐水洗下,经离心后去除上清液,再用生理盐水洗涤1~2次,最后将其稀释至一定浓度的悬液。
(2)配制青霉素标准溶液
①青霉素标准母液配制:准确称取纯苄青霉素钠盐15~20mg,在一定量的0.2mol/L磷酸缓冲液(pH=6)中溶解,使其成2000U/ml的青霉素溶液,冷藏存放。
②青霉素标准工作液配制:以标准母液配成10U/ml青霉素标准工作液。按下表加入10U/ml青霉素标准工作液,即配成不同浓度的青霉素标准工作液。
表3-1 不同浓度标准青霉素液的配法
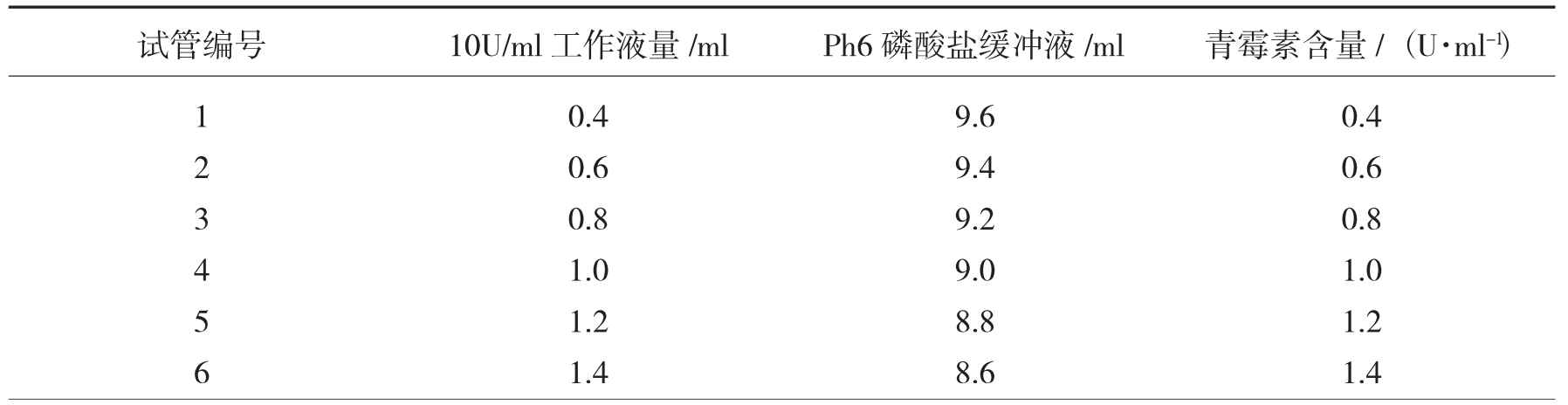
(3)绘制标准曲线
①铺底层培养基:取无菌培养皿15套,每皿移入20ml牛肉膏蛋白胨底层琼脂培养基,水平放置,待凝备用。
②铺含菌上层培养基:融化三角瓶中的牛肉膏蛋白胨琼脂培养基(100ml),待冷却到60℃左右时加入60%葡萄糖液12ml和金黄色葡萄球菌菌液3~5ml(加入菌液的浓度应控制在使1U/ml青霉素溶液的抑制菌圈直径在20~24mm),充分混匀后,吸取4ml迅速铺于底层平板上层,水平放置,待凝备用。
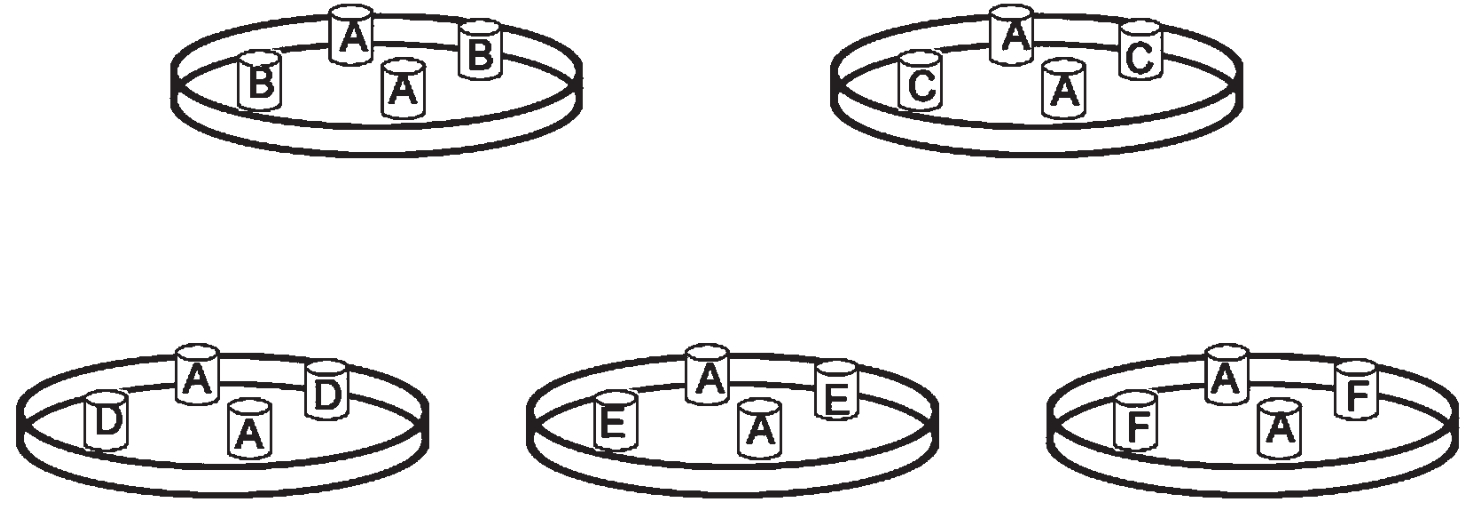
③放牛津小杯:待上层充分凝固后,在每个琼脂板上轻轻放置4支牛津小杯,其间距应相等,如图所示:
④滴加标准样品液:用无菌移液管或带滴头的滴管滴加标准样品液,每一稀释度应更换一支移液管或滴管,每支牛津小杯中的加量为0.2ml,每一稀释度做3个重复。加液量如下图所示,与杯口水平为准。
 (www.chuimin.cn)
(www.chuimin.cn)
图3-1 牛津小杯放置示意图
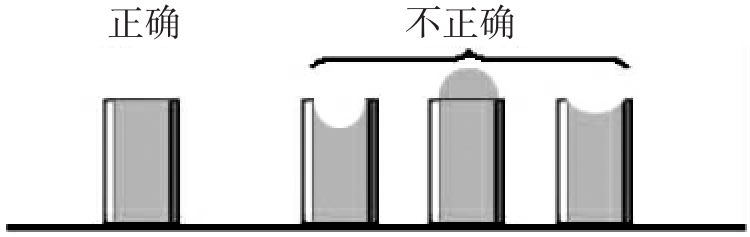
图3-2 液量示意图
⑤培养:加完样品后,最好换上无菌素烧瓷盖做培养皿的盖子,其吸湿性好,在盖内不易形成水滴,然后将平板置37℃恒温箱内培养18~24小时。
⑥测量与计算:先移去测定培养皿的素烧瓷盖,再移去牛津小杯,精确测量各稀释度的青霉素的抑制圈直径(用圆规两脚的针尖测量可提高精度)。计算方法:
a.算出各组(即各剂量)及各组1U/ml抑制圈的平均直径。
b.统计15套培养皿中1U/ml的抑制圈平均值。c.以1U/ml抑制圈的总平均值来校正各组的1U/ml抑制圈的平均值,即求得各组的校正值。d.以各组1U/ml的抑制圈的校正值校正各剂量单位浓度的抑制圈直径,即获得各组抑制圈的校正值。
举例:若30个1U/ml青霉素溶液的抑制圈直径的平均值为22.6mm,而第一组内6个1U/ml青霉素溶液的抑制圈直径的平均值为22.4mm,则:第一组的校正值=22.6-22.4=+0.20(mm)。若第一组皿内0.4U/ml青霉素溶液的抑制圈平均值为18.6mm,那么第一组0.4U/ml青霉素溶液的抑制圈校正值=18.6+0.2=18.8(mm)。其他各组依次类推获得各自的校正值。
⑦绘制标准曲线:在对数坐标纸上,以青霉素浓度(对数值)为纵坐标,以抑制圈直径的校正值为横坐标,绘制标准曲线。
(4)测定青霉素发酵液的效价
①在无菌培养皿内铺底层及含菌上层培养基,方法同上。
②待平板充分凝固后,每套含菌测定平板上均匀地放置4支牛津小杯,小杯中心坐落在培养皿两互相垂直直径的各自半径的中心。
③用摇瓶或发酵罐接种、培养青霉素高产分泌菌株——产黄青霉,用0.2mol/LpH6.0磷酸盐缓冲液对青霉素发酵液作适当稀释,每个被检验样品用3套培养皿测定其效价。
④在牛津小杯中加样品液,青霉素标准液(1U/ml)与发酵液的稀释液间隔地加入牛津小杯中,加液量务求准确,以降低操作误差。
⑤加完样品的平板放37℃下培养18~24小时后。
(5)青霉素发酵液效价的计算
①求校正值:将1U/ml青霉素标准测定液在培养皿中抑菌圈的平均值与曲线上1U/ml抑菌圈直径相互比较,以求得其校正值。
②校正发酵液的值:用此校正值校正被检发酵液抑菌圈直径,以求得发酵液的近似效价值。
③查对标准曲线值:用此校正值在标准曲线上查得被检青霉素发酵液(稀释液)的效价单位。
④发酵原液的效价:将上述效价值乘上其稀释倍数,即可求得青霉素发酵液原液的效价值。
5.记录结果
表3-2 绘制标准曲线的结果记录表
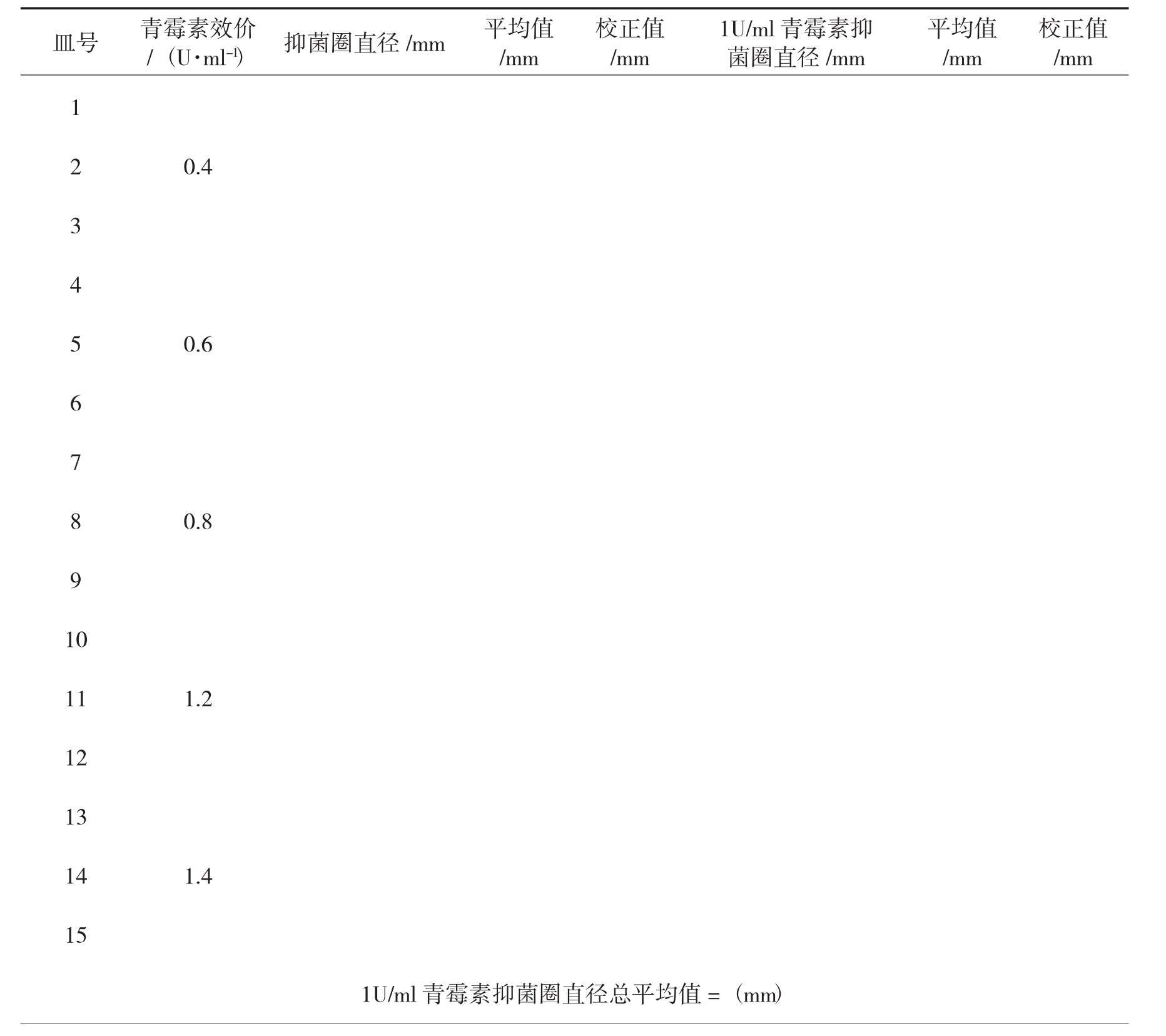
表3-3 测定青霉素效价的结果记录表
![]()

有关生物技术制药实验的文章

实验二基因工程干扰素效价的测定1.实验目的掌握干扰素的效价测定方法。分子生物学及基因工程技术的发展为大量生产细胞因子类药物提供了条件,而对于基因工程生产的干扰素,需要进行干扰素效价的测定。本实验采用细胞病变抑制法进行干扰素效价的测定。常用于测定干扰素效价的细胞为人二倍体细胞株,如人胚肌皮细胞次代培养物、人羊膜细胞Wish、FL及人喉癌细胞Hep-2均可。基因工程干扰素样品96孔培养板、Tip。......
2023-12-07

实验四重组尿激酶的效价测定尿激酶是一种分子量为54KDa的高度糖基化丝氨酸蛋白酶,初分泌时是无活性的单链,在其Lys-Ile处切开,则成为由二硫键连接的具有活性的双链尿激酶,即20 KDa的A链和34KDa的B链。重组尿激酶是将带有尿激酶基因的重组质粒转化大肠杆菌,高效表达尿激酶,经高度纯化后加入适量人血白蛋白稳定剂冻干制成。重组尿激酶活性的测定常见下面两种方法。尿激酶是丝氨酸蛋白酶,丝氨酸和组氨酸是其活性中心的必需氨基酸。......
2023-12-07

实验三十九酵母蔗糖酶的部分纯化与纯度测定一、酶的纯化1.实验目的掌握酵母蔗糖酶的部分纯化与纯度测定方法及原理。洗脱至混合器中液体流完为止,测定各接收管在280nm下的光吸收值,并用尿糖试纸进行半定量测定各管的酶活力,将最高酶活力的1管酶液作为第四组分用于纯度测定。尿糖试纸是固定化酶应用于临床检测糖尿病的实例。......
2023-12-07

实验二十八细胞生长曲线的测定1.实验目的掌握测定细胞生长曲线的方法。了解细胞生长发育的特性。除使用计数法测定细胞的生长曲线外,还可用MTT比色法间接测量。生长曲线常用于测定药物等外来因素对细胞生长的影响。在需要确知细胞数量的场合不宜用MTT法。......
2023-12-07

实验九RNA浓度、纯度的测定及浓度的调整1.实验目的掌握RNA浓度及纯度的测定方法,并能根据实验需要来调整其浓度。在一定范围内,DNA或RNA的光密度OD260与其含量成正比。对于RNA,根据其在230、260、280nm下紫外吸收值A230、A260、A280,可确定其纯度和浓度。......
2023-12-07

实验八糖化酶的制备及酶活力测定一、糖化酶的制备1.实验目的掌握糖化酶摇瓶实验的基本操作。显微镜观察菌丝形状,测量发酵液pH,测定糖化酶活力。葡萄糖分子中含有醛基,能被次碘酸钠氧化,过量的次碘酸钠酸化后析出碘,再用硫代硫酸钠标准溶液滴定,由此可计算酶活力。......
2023-12-07

实验五SOD的提取、分离及活性测定1.实验目的了解酶类药物的特性和功能,掌握提取、分离超氧化物歧化酶的基本原理和过程。大蒜蒜瓣和悬浮培养的大蒜细胞中含有较丰富的SOD,通过组织或细胞破碎后,可用pH7.8的磷酸缓冲液提取。将上述提取液、粗酶液和酶液分别取样,测定各自的SOD活力。......
2023-12-07

实验八真核细胞总RNA的提取1.实验目的掌握真核生物细胞基因组RNA制备及定量的基本方法。由于细胞内大部分RNA是以核蛋白复合体的形式存在,所以在提取RNA时要利用高浓度的蛋白质变性剂,迅速破坏细胞结构,使核蛋白与RNA分离,释放出RNA。再通过酚、氯仿等有机溶剂处理、离心,使RNA与其他细胞组分分离,得到纯化的总RNA。它既可破坏细胞结构使核酸从核蛋白中解离出来,又对RNA酶有强烈的变性作用。......
2023-12-07
相关推荐