该法广泛应用于分离、提纯、浓缩生物大分子及脱盐、去热源等,而测定蛋白质的相对分子质量也是它的重要应用之一。K a v是判断分离效果的一个重要参数,同时也是测定蛋白质相对分子质量的一个依据。以蛋白质相对分子质量的对数lgMr为纵坐标,Ve为横坐标绘制标准曲线。......
2023-11-06
实验十一 蛋白质药物的相对分子量及纯度测定
1.实验目的
学习并掌握SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)测定蛋白质分子量及蛋白质纯度的方法。
2.实验原理
SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)因易于操作和广泛的用途,使其成为许多研究领域中一种重要的分析技术。SDS-PAGE是对蛋白质进行量化、比较及特性鉴定的一种经济、快速,而且可重复的方法。该法主要依据蛋白质的分子量不同而对其进行分离。离子去污剂SDS与蛋白质的疏水部分相结合,可破坏蛋白质的折叠结构,并使其稳定地存在于一个广泛均一的溶液中。SDS-蛋白质复合物的长度与蛋白质的分子量成正比。在样品介质和聚丙烯酰胺凝胶中加入离子去污剂SDS和强还原剂后,蛋白质亚基的电泳迁移率主要取决于亚基分子量的大小,而电荷因素可以被忽略。因此可以利用SDS-PAGE分析蛋白质的分子量及蛋白质混合物的纯度。
3.实验试剂与器材
丙烯酰胺,N’,N’-甲叉双丙烯酰胺,SDS,TEMED,10%过硫酸铵,α-巯基乙醇,甘油,溴酚蓝,甘氨酸,盐酸,DTT,考马斯亮蓝R-250,甲醇,冰乙酸,垂直凝胶电泳装置,微量加样枪,电泳仪,沸水浴,eppendorf管,摇床。
4.操作步骤
(1)组装凝胶模具:将玻璃板、样品梳、Spacer用洗涤剂洗净,ddH2O冲洗数次,再用乙醇擦拭后晾干;然后将两块洗净的玻璃板之间加入Spacer,装好玻璃板。
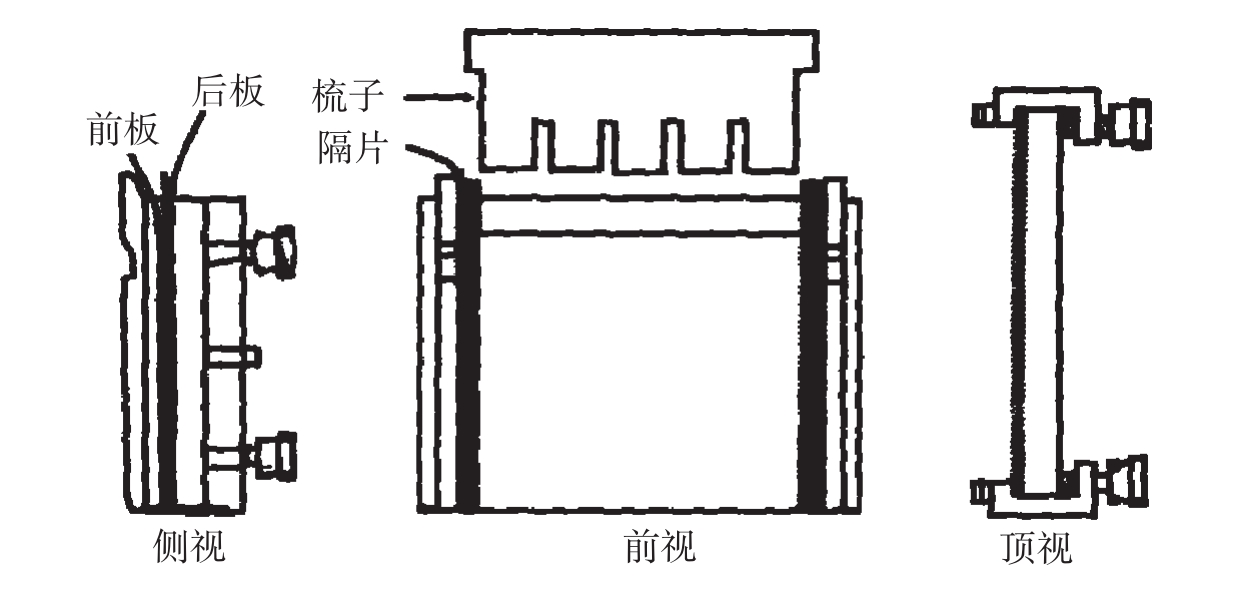
图2-8 凝胶模具组装示意图
(2)灌制分离胶:配制10%分离胶8.0ml,混匀后,将凝胶溶液小心加入模具内,立即覆一层重蒸水,大约20分钟后胶即可聚合,然后将上层重蒸水倾去,用滤纸吸干。
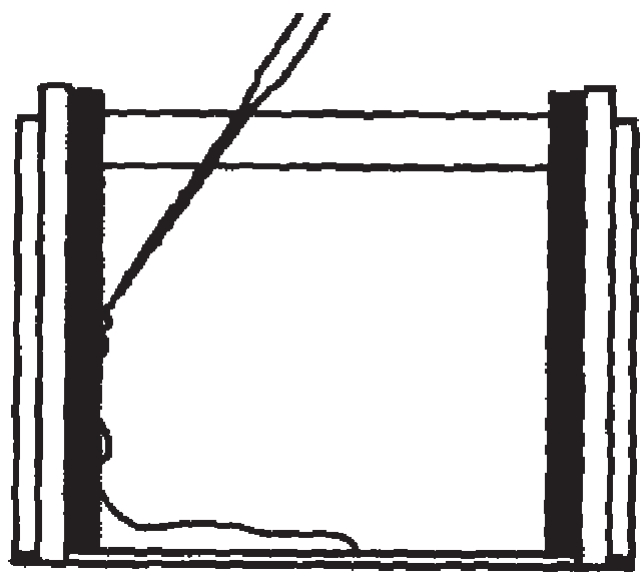
图2-9 用滴管灌制分离胶
(3)灌制浓缩胶:配制6%浓缩胶3.0ml,混匀,在分离胶的上层灌制浓缩胶,插入样品梳;等待30分钟,使凝胶聚合后,小心拔出梳子,不要将加样孔撕裂。
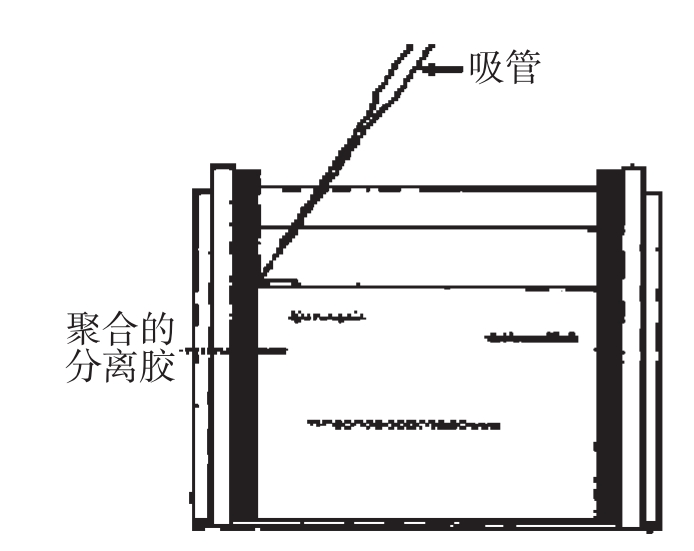
图2-10 将浓缩胶溶液用吸管加入凝胶模具图
 (www.chuimin.cn)
(www.chuimin.cn)
图2-11 将加样孔梳子插入浓缩胶
(4)装好电泳系统,加入电极缓冲液。
(5)制备样品和上样:样品加入等体积的样品缓冲液,在沸水浴中加热5分钟,取出,冷却,用微量加样枪加入上样孔中,如下图所示。
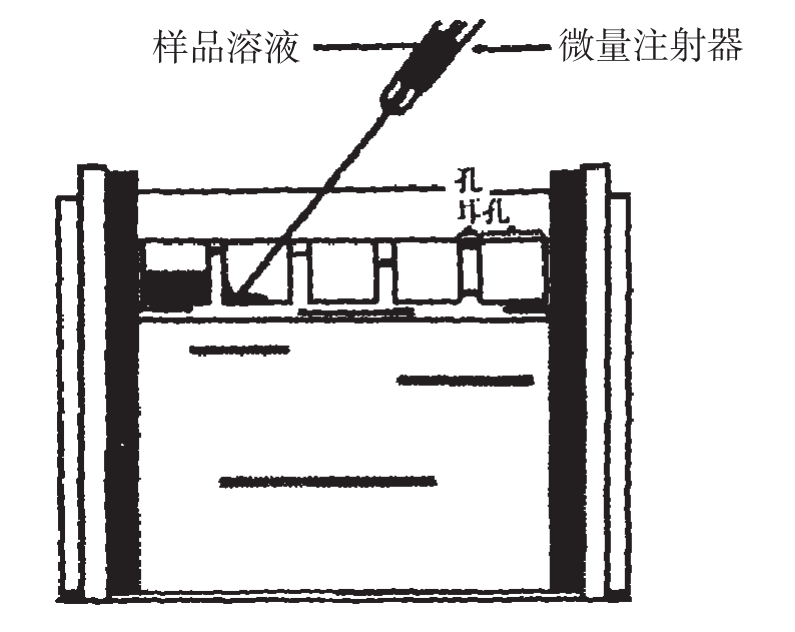
图2-12 将蛋白质样品加入样品孔中
![]()
![]()
(6)电泳:200V,100mA,溴酚蓝刚跑出分离胶时,停止电泳,大约需45分钟至1小时。
(7)染色及脱色:卸下胶板,剥离胶放入染色液(考马斯亮蓝)中,室温染色1~2小时;加入脱色液,置于80rpm脱色摇床上,每20分钟更换一次脱色液(10ml冰乙酸;45ml乙醇;45ml蒸馏水)至完全脱净。
5.结果分析
(1)以相对迁移率为横坐标,lgMW为纵坐标绘制标准曲线;由该标准曲线,根据迁移率Rf,测定样品蛋白质的分子量。
(2)根据染色的电泳胶板,分析各泳道样品的纯度。
6.注意事项
SDS-PAGE胶的干燥:凝胶干燥时遇到的主要问题是凝胶的变形和破裂。将凝胶放在Whatman3MM滤纸上可防止干燥凝胶变形,但凝胶是否破裂取决于凝胶的厚度和干燥器的质量,因此,应尽量使用薄胶并使凝胶干燥器处于良好状态,使其真空压力波动极少。
7.思考题
(1)出现异常迁移的原因是什么,如何解决?
(2)如果某一样品出现两条带,可能是哪些原因引起的?是否表明该样品一定是不纯的?
有关生物技术制药实验的文章

该法广泛应用于分离、提纯、浓缩生物大分子及脱盐、去热源等,而测定蛋白质的相对分子质量也是它的重要应用之一。K a v是判断分离效果的一个重要参数,同时也是测定蛋白质相对分子质量的一个依据。以蛋白质相对分子质量的对数lgMr为纵坐标,Ve为横坐标绘制标准曲线。......
2023-11-06

如果在聚丙烯酰胺凝胶系统中加入十二烷基硫酸钠,则蛋白质分子的电泳迁移率主要取决于它的相对分子质量,而与所带电荷和形状无关,因此可以利用SDS-PAGE测定蛋白质相对分子质量。因此,在电泳过程中,迁移率仅取决于蛋白质-SDS复合物的大小,也可以说是取决于蛋白质相对分子质量的大小。标准蛋白质相对分子质量见表4-1。②待测蛋白质样品的处理。......
2023-11-06

用来溶解标准蛋白质及待测固体。根据样品蛋白质的相对迁移率从标准曲线上查出其分子量。用SDS凝胶电泳法测定分子量时,每次测量样品都必须同时作标准曲线,而不得利用另一次电泳的标准曲线。......
2023-11-09

标准曲线法测定蛋白质含量掌握分光光度计的使用方法。掌握双缩脲法测定蛋白质含量的方法。蛋白质含有两个以上肽键,因此有双缩脲反应。其颜色深浅与蛋白质的浓度成正比,而与蛋白质的相对分子量及氨基酸成分无关,故可用比色法测定,制作标准曲线并测定蛋白质含量。此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。因此双缩脲法常用于需要快速,但并不需要十分精确的蛋白质测定。......
2023-11-09

(三)多肽和蛋白质类药物的主要生物生产方法提取法提取法是指通过生化工程技术,从天然动植物及重组动植物体中分离纯化多肽与蛋白质。发酵法微生物发酵法是多肽与蛋白质类药物的主要生产方式。多肽和蛋白质类药物多数属于人体特有的细胞因子、激素、蛋白质,这些蛋白质与动物体所含的蛋白质存在结构上的差异。目前,经过基因工程方法可生产绝大多数多肽和蛋白质类药物。......
2023-06-24

蛋白质是生物大分子,相对分子质量变化范围很大,小者数千,大者数千万。高度不对称的分子和具有相同相对分子质量的球形蛋白质相比,具有较高的黏度。用此法可以鉴定蛋白质的存在或测定其含量。(二)蛋白质的药用价值蛋白质的药用价值列于表1-4-2中。......
2023-06-24

实验九RNA浓度、纯度的测定及浓度的调整1.实验目的掌握RNA浓度及纯度的测定方法,并能根据实验需要来调整其浓度。在一定范围内,DNA或RNA的光密度OD260与其含量成正比。对于RNA,根据其在230、260、280nm下紫外吸收值A230、A260、A280,可确定其纯度和浓度。......
2023-12-07

实验类型 综合性教学时数 9一、实验目的学习微量凯式定氮法测定蛋白质含量的原理。了解微量凯氏定氮仪的结构,掌握微量凯式定氮法测定蛋白质含量的操作方法。生物材料总氮量的测定,通常采用微量凯氏定氮法。凯氏定氮法由于具有测定正确度高,可测定各种不同形态样品等优点,被公认为是测定蛋白质含量的标准分析方法。精确称量已达恒重的样品0.1g作为本次实验测试样品。待样品和空白消化液均蒸馏完毕,同时进行滴定。......
2023-11-04
相关推荐