选择合适的pH及适当浓度的三氯乙酸或丙酮,可以从蛋清中除去大量的非卵类黏蛋白,获得鸡卵类黏蛋白的粗提液。初步纯化的鸡卵类黏蛋白,经DEAE-纤维素离子交换柱进一步纯化,可除去少量的杂蛋白,得到鸡卵类黏蛋白的纯溶液。鸡卵类黏蛋白在280nm处的消光系数=4.13,即蛋白质浓度为1mg/mL时溶液的吸光度A280=0.413,据此可以测定鸡卵类黏蛋白的含量。将收集的蛋白液体放置冰箱,准备进一步用DEAE-纤维素柱层析纯化。......
2023-11-06
实验二 基因工程表达产物分离纯化
1.实验目的
熟悉大肠杆菌包涵体表达产物的分离纯化原理及工艺流程。
2.基因工程表达产物分离纯化原理
当外源基因在宿主细胞内高效表达时,由于宿主细胞内的微环境不利于表达产物的折叠,表达产物正确折叠的速度跟不上产物形成的速度,从而使表达产物主要以不溶的、无序折叠的包涵体形式存在。
(1)包涵体蛋白的变性与复性
包涵体是水不溶性颗粒,其密度高于所有细胞器,可采用差速离心法从工程菌细胞裂解物中获得包涵体。包涵体是由表达产物、膜脂蛋白、DNA、RNA、脂类和多糖等众多大分子物质组成的复杂混合物,采用表面活性剂(如TritonX100)或/和低浓度尿素等去除包涵体表面的各种杂质可适当提高包涵体蛋白中目的产物的含量,便于进一步分离纯化。包涵体蛋白的变性:利用高浓度的变性剂如8M尿素破坏包涵体蛋白质中的氢键,以还原性巯基试剂(如DTT、β-ME)破坏分子间和分子内的二硫键,使蛋白质的多肽链处于完全自由伸展状态。
包涵体蛋白质的复性:采用适当的方法去除变性剂,使表达产物由自由伸展状态转变为正确折叠状态,恢复蛋白质天然构象和活性的过程称为复性。理论上,只要体外给予适当条件,任何处于自由伸展状态的多肽链都有形成正确折叠的可能。
蛋白质折叠的具体步骤可描述为:
U→I→N
↓
A
U表示伸展态,I为中间体,N是天然态,A为凝聚物。在折叠反应中,从伸展态到中间体的形成非常快速,一般在毫秒范围内即可完成,但从中间体转变为天然态的过程则比较缓慢,是反应的限速步骤。在蛋白质复性时,主要是促进中间体向天然态的转变。一般认为,蛋白质在复性过程中,涉及两种疏水作用,一是分子内的疏水作用,二是部分折叠的肽链分子间的疏水作用。前者促使蛋白质正确折叠,后者导致蛋白质聚集而无活性,两者互相竞争,影响蛋白质复性收率。因此,在复性过程中,抑制肽链间的疏水作用以防止聚集,是提高复性收率的关键。在实际操作中,采用较低的蛋白浓度、缓慢降低变性剂浓度、以化学或物理方法减少分子间的碰撞机会是减少分子间聚沉的常用方法。
对于含二硫键的蛋白质,二硫键的形成在多肽链的重折叠,即蛋白质复性中起决定性作用。包涵体蛋白变性后,所有半胱氨酸的巯基(-SH)处于还原状态,在蛋白的复性过程中,组成二硫键的两个半胱氨酸残基间的巯基氧化形成共价的二硫键。二硫键的形成速度以及半胱氨酸残基间配对的正确性决定了复性的速度和复性产物空间结构的正确性。当天然的蛋白质或多肽存在多对二硫键时,变性蛋白折叠过程中二硫键的形成位点至关重要。理论上,二硫键的形成信息决定于蛋白质的一级结构信息,因此只要复性条件适当,蛋白质复性过程中分子内或分子间即能形成正确的二硫键。为了促进巯基的氧化和二硫键的形成,一般在复性体系中采用还原型谷胱甘肽(-SH)-氧化型谷胱甘肽(S-S)或半胱氨酸(-SH)-胱氨酸(S-S)组成的氧化还原体系。
(2)目的表达产物的分离纯化
目的表达产物的分离纯化策略多种多样。可先复性再分离纯化,也可先纯化变性蛋白再复性或复性与纯化同时进行。
①先复性再纯化
以包涵体形式表达的产物经复性后,采用各种色谱柱技术进行进一步的分离纯化。疏水层析、离子交换层析和分子筛层析是最常用的制备型色谱技术,一般采用2~3步柱层析即可获得纯度超过95%的表达产物,而且可有效去除宿主核酸、内毒素以及非正确折叠的异构体。以融合方式表达的产物,实验室常采用Tag的抗体或受体设计亲和层析来纯化,但此类方法由于成本高、亲和介质寿命短及配基污染等问题而不适用于工业化生产。
②先纯化变性蛋白再复性
即在高浓度变性剂存在条件下,先通过各种色谱柱技术获得纯的变性蛋白,然后以纯的变性蛋白进行稀释复性,再以柱层析去除非正确折叠的产物。
③复性与纯化同时进行
以各种柱层析方法复性,并在复性过程中进行纯化。
3.表达产物分离纯化工艺流程
建立目的产物的高效和质量可控的分离纯化工艺是基因工程制药的最主要技术瓶颈之一。大肠杆菌系统表达产物分离纯化的主要任务是高效获取高比活性的表达产物,去除宿主蛋白质、核酸、内毒素等主要杂质类型。基于包涵体表达形式的表达产物分离纯化工艺流程为:
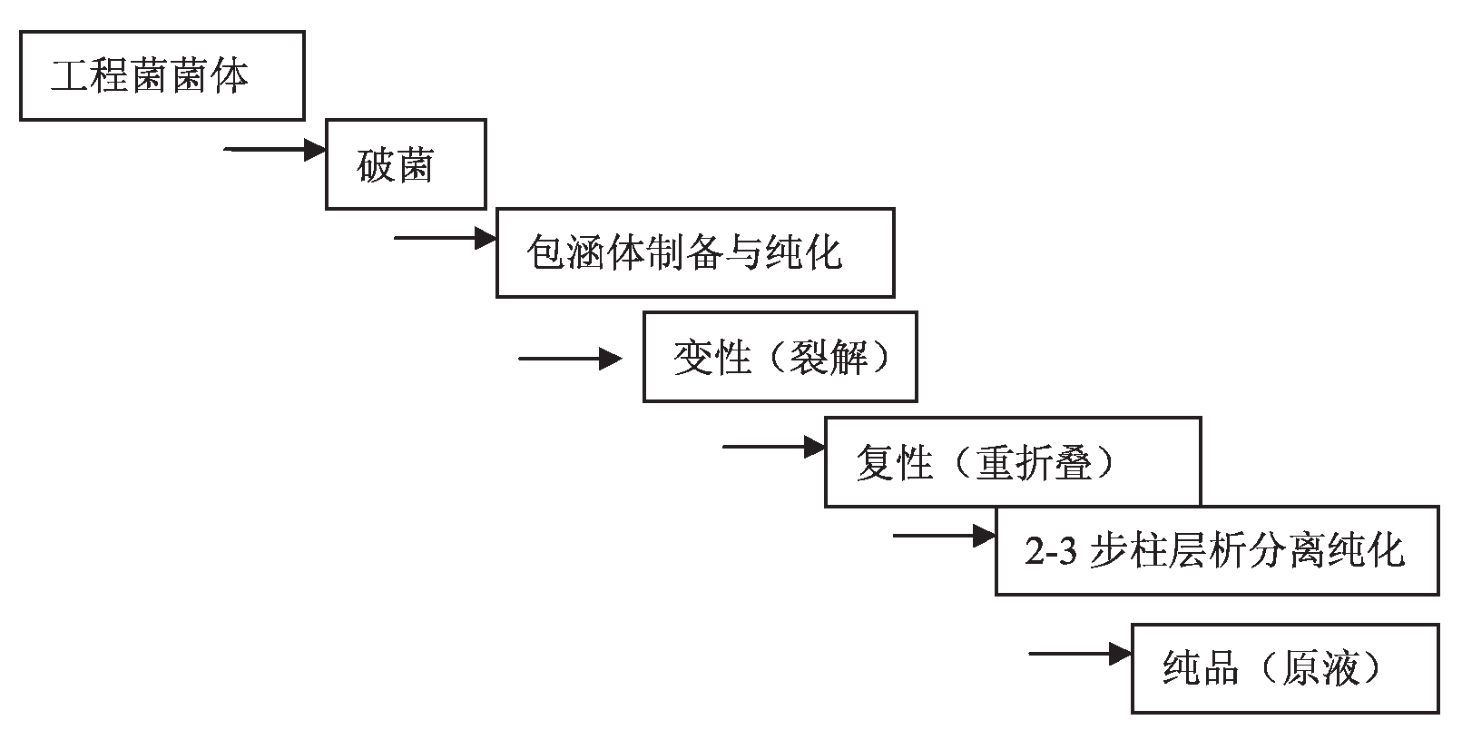
图2-2 表达产物分离纯化工艺流程图
4.实验材料及试剂
(1)发酵菌体、Tris、HCl、EDTA、尿素、TritonX-100、二硫苏糖醇(DTT)、谷胱甘肽系统(氧化型、还原型)。
(2)菌体裂解液:20mMTris-HCl(pH8.0)、1mMEDTA。
(3)包涵体洗涤缓冲液I:20mMTris-HCl(pH8.0)、1mMEDTA、2M尿素。(www.chuimin.cn)
(4)包涵体洗涤缓冲液II:20mMTris-HCl(pH8.0)、1mMEDTA、1%TritonX-100。
(5)包涵体洗涤缓冲液III:20mMTris-HCl(pH8.0)、1mMEDTA、20mMNaCl。
(6)包涵体裂解缓冲液:20mMTris-HCl(pH8.0)、8M尿素。
(7)包涵体复性缓冲液:20mMTris-HCl(pH8.0)、谷胱甘肽系统。
5.实验仪器与器材
冷冻离心机、天平、超声波仪、50ml烧杯、50ml离心管、EP管、玻璃棒。
6.实验步骤
(1)将发酵菌液离心,4℃,5000rpm,5分钟(同时取100ul菌液4℃保存,作为1号样品)。
(2)弃上清,收集菌体沉淀,称菌体湿重,用菌体裂解液悬浮菌体(稀释度30%(W/V))。
(3)在冰浴条件下,用超声仪破碎菌体悬浮液(探头插入悬浮液)。超声破碎条件依超声仪功率而定,当超声仪功率300W时,每次可处理菌体悬浮液30ml,一般总超声15分钟,超声3秒停2秒。
(4)离心,4℃,10000rpm,10分钟,弃上清(用无菌牙签挑取大约牙签粗头大小的沉淀,编号2号,溶于40ul1×SDS上样缓冲液中备用)。
(5)将沉淀悬浮于包涵体洗涤缓冲液I(5%(W/V)),充分混匀。4℃,10000rpm,离心10分钟,弃上清。
(6)将沉淀悬浮于包涵体洗涤缓冲液II(5%(W/V)),充分混匀。4℃,10000rpm,离心10分钟,弃上清。
(7)再将沉淀悬浮于包涵体洗涤缓冲液III(5%(W/V)),充分混匀。4℃,10000rpm,离心10分钟,弃上清。
(8)最后所得沉淀即为包涵体样品,将其称重,用无菌牙签挑取约牙签粗头大小,编号3号,溶于40ul1×SDS上样缓冲液中备用。
(9)将包涵体按5%(W/V)的稀释度重新悬浮于包涵体洗涤缓冲液III,充分混匀,分装至1.5mlEP管,每管1ml,-20℃冻存。
(10)每小组取包涵体样品1支,室温解冻,4℃,10000rpm,离心10分钟,弃上清,加入1ml包涵体裂解缓冲液,充分混匀,37℃保温3小时。
(11)4℃,10000rpm,离心10分钟。(上清留样20ul,编号4号,加20ul2×SDS上样缓冲液。沉淀用无菌牙签挑取牙签粗头大小,编号5号,溶于40ul1×SDS上样缓冲液中备用。)
(12)将上清移至10ml试管,缓慢滴加包涵体复性缓冲液至尿素终浓度为2M(稀释4倍),4℃过夜。
(13)取100ul复性液于EP管,4℃,12000rpm,离心10分钟,上清取样20ul,编号6号,加20ul2×SDS上样缓冲液;沉淀加40ul1×SDS上样缓冲液,编号7号。
(14)将上述1~7号样品进行SDS-PAGE分析。
7.注意事项
(1)使用超声波时,超声强度要低于溶液产生泡沫的水平,产生泡沫会导致蛋白质变性。
(2)蛋白复性时,一定要缓慢加入包涵体复性缓冲液,以防止变化太快造成蛋白质聚集析出。
8.思考题
(1)如何分离包涵体?
(2)蛋白质复性的方法有哪些?
(3)本实验对包涵体纯化复性的策略是什么?
有关生物技术制药实验的文章

选择合适的pH及适当浓度的三氯乙酸或丙酮,可以从蛋清中除去大量的非卵类黏蛋白,获得鸡卵类黏蛋白的粗提液。初步纯化的鸡卵类黏蛋白,经DEAE-纤维素离子交换柱进一步纯化,可除去少量的杂蛋白,得到鸡卵类黏蛋白的纯溶液。鸡卵类黏蛋白在280nm处的消光系数=4.13,即蛋白质浓度为1mg/mL时溶液的吸光度A280=0.413,据此可以测定鸡卵类黏蛋白的含量。将收集的蛋白液体放置冰箱,准备进一步用DEAE-纤维素柱层析纯化。......
2023-11-06

糖化酶广泛分布于能直接以淀粉为营养源的所有生物体中。糖化酶的分离纯化实质是活性蛋白质的提纯过程。实验中选用工业糖化酶粗粉为原料。经离心分离获得的沉淀部分即为糖化酶的粗制品。经盐析法初步分离的糖化酶溶液含有大量的硫酸铵,会妨碍酶的进一步纯化,因此必须去除。脱盐后的糖化酶溶液经等电点沉淀、有机溶剂沉淀等处理可得到较纯的酶制剂。合并经检查不含的各管收集液,即为脱盐后的糖化酶液。......
2023-11-06

(一)蛋白质的表达、分离、纯化了解重组蛋白表达的方法和意义。目的基因在宿主细胞中的高效表达及表达的重组蛋白的分离、纯化及理论研究和实验应用都具有重要的意义。蛋白质的纯化程度可通过聚丙烯酰胺凝胶电泳进行分析。......
2023-11-06

实验十蛋白质类药物的分离、纯化1.实验目的理解凝胶过滤层析法分离、纯化物质的基本原理。理论上凝胶过滤不涉及蛋白质与凝胶之间的吸附或排斥作用。凝胶过滤柱是由均匀装填的多孔凝胶微粒组成,不同蛋白质通过这些微孔的迁移能力不同,从而使蛋白质被分离。......
2023-12-07

实验六蒸馏(一)实验目的1.了解沸点的定义。(二)实验原理蒸馏是提纯液体物质和分离混合物的一种常用方法。实验证明,液体的蒸气压只与温度有关,即液体在一定温度下具有一定的蒸气压。很明显,通过蒸馏可将沸点不同的各组分分开。此时,应停止蒸馏。图2-10常用的蒸馏装置在装仪器之前,首先根据蒸馏物质的沸点及量的多少,选择合适的冷凝管和大小合适的蒸馏瓶。要注意漏斗下口处的斜面应超过蒸馏头支管的下限。......
2024-08-20

(一)血清γ-球蛋白的分离与纯化1.了解蛋白质分离纯化的总体思路。本实验在血清中加50%饱和度的硫酸铵,使球蛋白沉淀析出,清蛋白则仍溶解于溶解中,经离心分离获得沉淀部分即为含有γ-球蛋白的粗制品。脱盐后的γ-球蛋白再经DEAE纤维素层析柱进一步纯化。血清γ-球蛋白分离纯化后,选用醋酸纤维薄膜电泳法鉴定其纯度。合并含有蛋白质的各管,即为已脱盐的γ-球蛋白溶液,待进一步纯化。......
2023-11-06

可利用低温下不同的脂肪酸或脂肪酸盐在有机溶剂中的溶解度不同来进行分离纯化。(二)尿素包合法尿素包合法是针对脂肪酸进行分离纯化的主要方法。饱和脂肪酸相对于不饱和脂肪酸更易与尿素化合,形成稳定配合物。结晶法是一种温和的分离程序,对于易氧化的多烯酸、饱和脂肪酸与单烯酸的分离,常用溶剂有甲醇、乙醚、石油醚和丙酮等,每克常用5~10 mL溶剂稀释。......
2023-06-24

(一)SOD的性质超氧化物歧化酶,是一种生物活性蛋白质,是人体不可缺少的氧自由基清除剂,也是目前为止发现的唯一的以自由基为底物的酶。它广泛存在于各类生物体内,按其所含金属离子的不同,可分为3种:铜锌超氧化物歧化酶、锰超氧化物歧化酶和铁超氧化物歧化酶。离子交换层析是依据各种离子或离子化合物与离子交换剂的结合力不同而进行分离纯化的。......
2023-11-06
相关推荐