实验三十九酵母蔗糖酶的部分纯化与纯度测定一、酶的纯化1.实验目的掌握酵母蔗糖酶的部分纯化与纯度测定方法及原理。洗脱至混合器中液体流完为止,测定各接收管在280nm下的光吸收值,并用尿糖试纸进行半定量测定各管的酶活力,将最高酶活力的1管酶液作为第四组分用于纯度测定。尿糖试纸是固定化酶应用于临床检测糖尿病的实例。......
2023-12-07
1.实验目的
(1)掌握酵母蔗糖酶活力测定方法及其原理
(2)掌握酵母蔗糖酶的酶促动力学研究方法
2.实验原理
酶促动力学研究酶促反应的速度及影响速度的各种因素,而米氏常数Km值等于酶促反应速度为最大速度一般时所对应的底物浓度,其值大小与酶的浓度无关,是酶促反应的特征常数。不同酶的Km值不同,同一种酶与不同的底物反应时,其Km值也不同,Km值反映了酶和底物亲和力的强弱程度,Km值越大,表明酶和底物的亲和力越弱;Km值越小,表明酶与底物的亲和力越强。
酶的活力就是酶所催活的反应速度,通常用单位时间内底物的减少或产物的增加来表示。酶反应过程中产物的生成和时间的关系可以用进程曲线来说明,曲线的斜率就是酶反应过程中的反应速度。从进程曲线来看,在一定时间内反应速度维持恒定,但随着时间的延长,反应速度逐渐降低,这是由多种因素造成的。所以,为了准确表示酶的反应速度必须采用初速度,即保持恒定时的速度。同样,不同酶浓度下的反应进程曲线也可以说明这个问题。酶活力可以被某些物质改变,凡能降低酶的活力甚至使酶失活的物质,均称为抑制剂,其中又有可逆抑制和不可逆抑制两种类型。而可逆抑制又包括竞争性抑制、非竞争性抑制等类型。在有抑制剂存在的条件下,酶的一些动力学性质会发生改变,如Km,Vmax等,可通过作图法求得,作图法很多,最常用的就是Lineweaver-Burk作图法(即双倒数作图法)。
3.实验仪器和试剂
恒温水浴锅,电炉,722分光光度计,0.2mol/L乙酸缓冲液,0.5mol/L蔗糖溶液,8mol/L脲。
4.实验步骤
(1)时间作用曲线
取试管编号,按下列顺序加入各种试剂,待测酶样用组分4,其稀释倍数以酶活力测定时的数据为准。
表1-21 试剂表
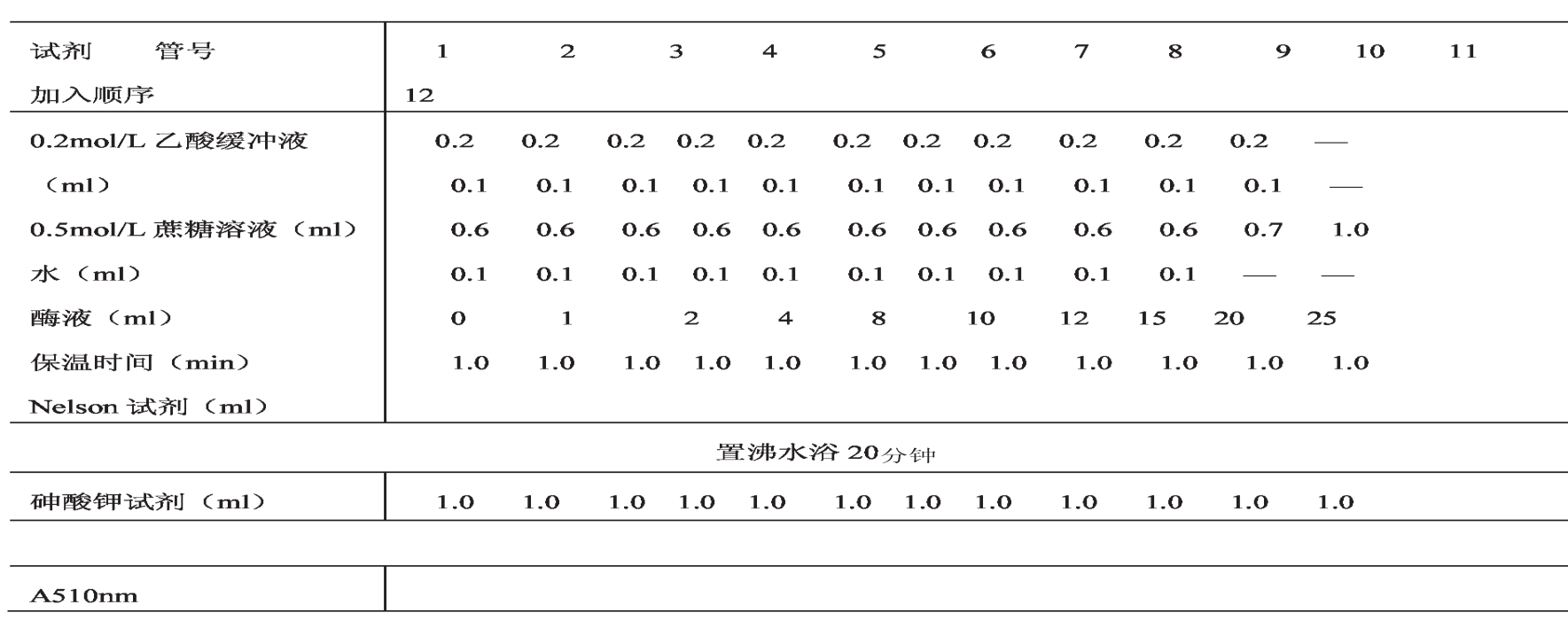
表1-22
 (www.chuimin.cn)
(www.chuimin.cn)
以还原糖的量(μmol)为纵坐标,时间为横坐标作时间作用曲线。
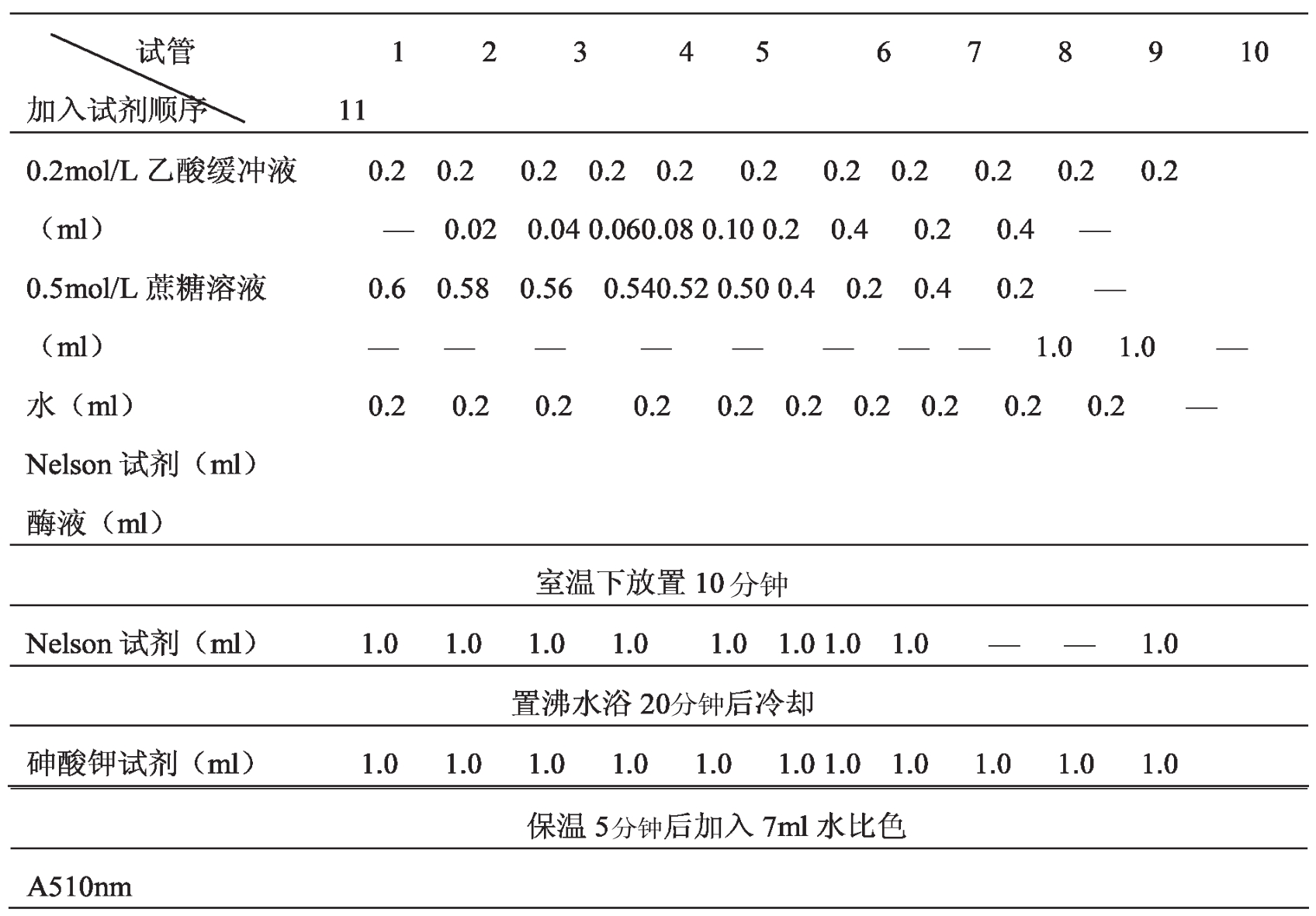
(2)底物浓度的影响
表1-23
![]()
![]()
取试管编号,按下表加样。
计算个试管中的蔗糖浓度和反应速率V(单位:),用反应速率对底物浓度作图,再用1/V对1/S作图,计算Km和Vmax。
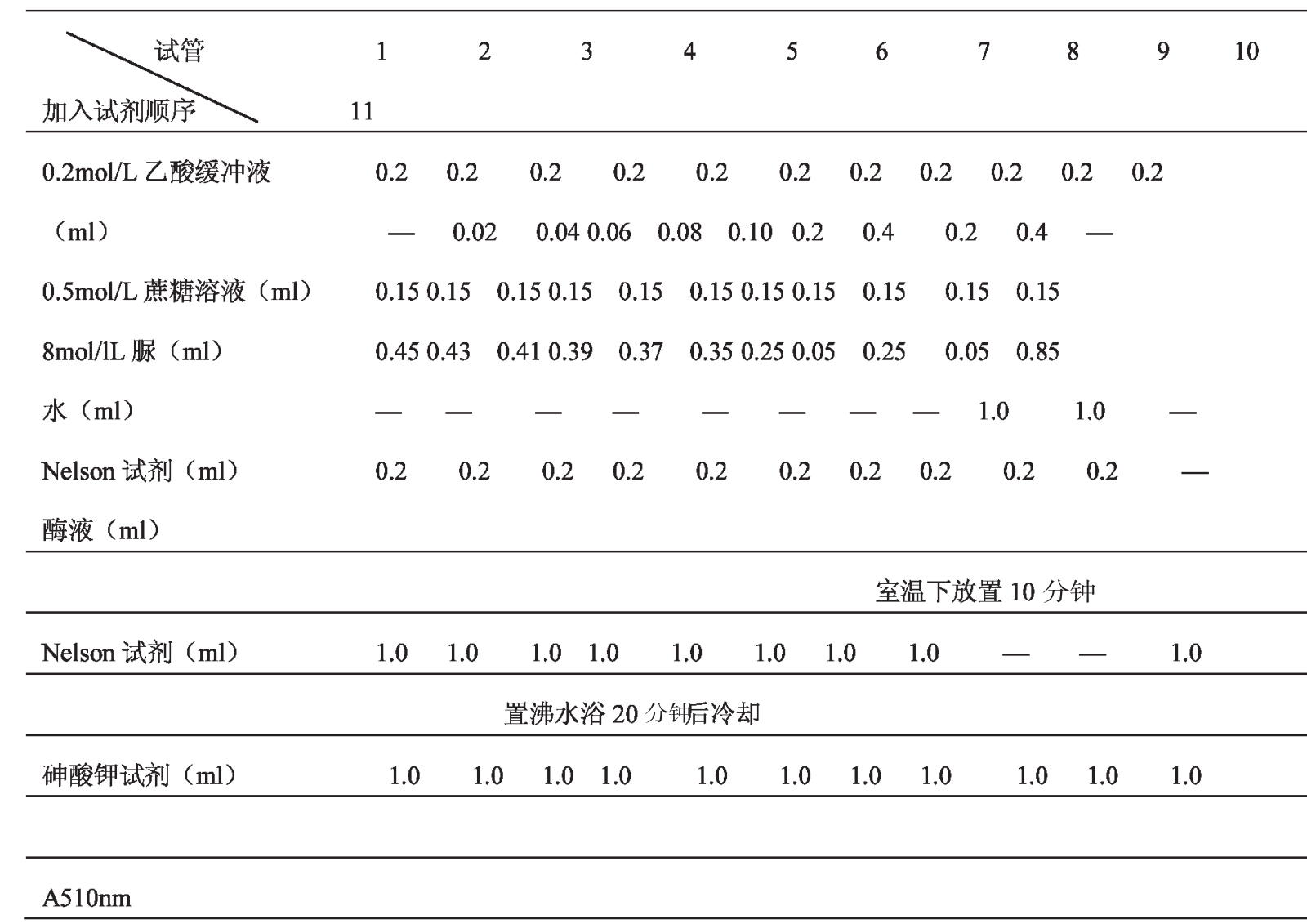
(3)脲对蔗糖酶的抑制
取试管编号,按下表加各种试剂。
以反应速率对底物浓度作图,再用1/V对1/S作图,计算出表观Km、Vmax、Ki,说明其抑制类型。
5.注意事项
(1)研究酶的活力应以酶促反应的初速度为准。
(2)本实验采用的是一种定量测定方法,为获得准确的实验结果,应尽量减少实验操作带来的误差。因此,在配置各种底物浓度时,应用同一母液进行稀释,以保证底物浓度的准确性。各种试剂的加样量也应准确,并严格控制酶促反应时间。
有关生物技术制药实验的文章

实验三十九酵母蔗糖酶的部分纯化与纯度测定一、酶的纯化1.实验目的掌握酵母蔗糖酶的部分纯化与纯度测定方法及原理。洗脱至混合器中液体流完为止,测定各接收管在280nm下的光吸收值,并用尿糖试纸进行半定量测定各管的酶活力,将最高酶活力的1管酶液作为第四组分用于纯度测定。尿糖试纸是固定化酶应用于临床检测糖尿病的实例。......
2023-12-07

实验四十一酵母蔗糖酶的结晶1.实验目的掌握酵母蔗糖酶的结晶方法2.实验原理常用的蛋白质结晶方法有:微池法结晶,蒸汽扩散法,液—液扩散法和透析结晶法等。此步操作为丙酮一硫酸铵协同除杂。将得到的酵母蔗糖酶的晶体显微镜下观察形态并描述,用测微尺测量晶体尺寸并记录。......
2023-12-07

实验七菠萝蛋白酶的制备及酶活力测定1.实验目的理解并掌握菠萝蛋白酶制备的基本原理和操作方法。菠萝蛋白酶活力测定①取酶制品0.15g,加入0.15mol/L磷酸缓冲溶液定容至100ml。......
2023-12-07

(二)固定化细胞的天冬氨酸酶活力的测定取相当于0.5 g天然细胞的固定化细胞,置于30 mL 1.0 mol/L延胡索酸铵溶液,37℃搅拌反应30 min,迅速过滤除去固定化细胞,分离反应液,经稀释后于240 nm波长处测定吸光度,计算延胡索酸残余量,并计算每克固定化细胞的酶表现活力。表2-5-1标准曲线的绘制根据测定的吸光度,作出标准曲线,得出回归方程。......
2023-06-24

溶菌酶广泛用于医学临床,有抗菌的作用,可抗感染、消炎、消肿、增强体内免疫反应等。另外,近年来溶菌酶已成为基因工程及细胞工程必不可少的工具酶。测定溶菌酶活力时,可用某些细菌细胞壁作底物,以单位时间内被它水解的细胞壁的量表示酶活力的大小。因此,可利用测定450nm波长下,菌悬液在该酶作用后透光度增加,以此表示溶菌酶的活力。计算所得溶菌酶的酶活力单位。......
2023-11-06

掌握谷丙转氨酶活力的测定方法。本实验以丙氨酸及α—酮戊二酸作为谷丙转氨酶作用的底物,利用内源性磷酸吡哆醛作辅酶,在一定条件及时间作用后测定所生成的丙酮酸的量来确定其酶活力。经转氨基作用后,α—酮戊二酸减少而丙酮酸增加,因此在波长520m处吸光度增加的程度与反应体系中丙酮酸与α—酮戊二酸的摩尔比基本上呈线性关系,故可测定谷丙转氨酶的活力。在标准曲线上查出丙酮酸的μmol数,计算每100mL血清中转氨酶的活力单位数。......
2023-11-04

实验八糖化酶的制备及酶活力测定一、糖化酶的制备1.实验目的掌握糖化酶摇瓶实验的基本操作。显微镜观察菌丝形状,测量发酵液pH,测定糖化酶活力。葡萄糖分子中含有醛基,能被次碘酸钠氧化,过量的次碘酸钠酸化后析出碘,再用硫代硫酸钠标准溶液滴定,由此可计算酶活力。......
2023-12-07

学习福林-酚法测定蛋白酶活力的原理和操作方法。枯草芽孢杆菌蛋白酶粉。表3-21 酪氨酸标准曲线的绘制以不含酪氨酸的“0”号管为空白,分别测定各管吸光度。滤液根据酶活力再次用缓冲液稀释至适当浓度供测试用。......
2023-11-06
相关推荐