水是最常用的溶剂,配制试剂、标准物质、洗涤时均需大量使用。市售蒸馏水或去离子水必须经检验合格才能使用。实验室中应配备相应的提纯装置。其电阻率约0.5MΩ cm,适用于配制一般定量分析试剂,不宜用于配制分析重金属或痕量非金属试剂。但应注意保存,一旦接触空气,在不到5min内可迅速降至2MΩ·cm。自然曝气夏季约需1d,冬季需3d以上,如急用可煮沸、搅拌、曝气并冷却后使用。......
2023-11-23
1.实验目的
熟练掌握培养基(RPMll640和DMEM)、Hanks、D-Hanks液等平衡盐溶液及消化液(胰酶液)的配制方法。
2.实验原理
细胞培养所用的培养基一般是由合成培养基和小牛血清配制而成。合成培养基现已有商品出售,它是根据细胞生长的需要按一定配方制成的粉状物质。其主要成分是氨基酸、维生素、碳水化合物、无机离子和其他辅助物质。它的酸碱度和渗透压与活体内细胞外液相似。小牛血清含有一定的营养成分,更重要的是它含有细胞生长所必需的生长因子、激素、贴附因子等,这是合成培养基所无法替代的。此外它还能中和有毒物质的毒性。故一般体外培养细胞时要加入一定量的小牛血清(10%~20%)。
Hanks液是常见的平衡盐溶液(BSS)之一。D-Hanks液则是无钙镁离子的Hanks液。BSS与细胞生长状态下的pH值、渗透压及无菌状态一致,是组织培养基本用液,常用于配制培养基及其他用液,或者用来洗细胞等,细胞在BSS中可生存几个小时。
胰蛋白酶(胰酶)溶液是一种常用的细胞消化液,原代培养时用于处理组织块,使细胞分离下来。传代时用胰蛋白酶来消化贴壁细胞,并分散成单个细胞。胰蛋白酶主要采自牛或猪的胰脏,呈白色粉末状,易潮解,应在低温干燥处保存。胰蛋白酶对细胞的分离效果与细胞的类型、特性和瓶壁表面特性有关。一般来说浓度大、温度高(勿高于37℃)、作用时间长,对细胞分离能力大。但超过一定程度会损伤细胞,导致细胞传代后不能贴壁或死亡。胰酶在pH8.0、37℃时消化能力最强。溶液中的Ca2+、Mg2+和血清会降低胰酶活力,所以配制胰酶时须用无Ca2+、Mg2+的D-Hanks液。当消化结束时,可加入少量血清或含血清的培养基以终止胰酶作用。细胞传代使用的胰酶浓度是0.25%或0.2%。用于原代细胞培养消化组织块则为0.1%或0.125%。
3.实验试剂
无离子水,小牛血清,合成培养基(RPMI l640或DMEM),青霉素,链霉素,NaHCO3,NaCl,Na2HPO4,KH2PO4,KCl,酚红,NaHCO3,胰蛋白酶干粉,0.02%EDTA,CaCl2,D-葡萄糖,MgCl2·6H2O,MgSO4·7H2O,酚红(2%)(配法:称酚红2g,置于研磨器中,先用数滴5.6%的NaHCO3溶液溶解并研磨,再加进该5.6%NaHCO3溶液使最终体积为100ml。瓶装保存,备用)。
4.实验仪器与器材
滤泵(进口)1套,滤器(进口)1套,蒸馏器,高压灭菌锅,磁力搅拌器,锥形瓶,培液瓶,翻帽塞,饭盒,pH试纸,孔径0.22μm的微孔滤膜。
5.实验步骤
(1)准备和安装过滤器
①清洗好过滤器,干燥,安装好一张孔径0.22μm的微孔滤膜,用布包装好,进行高压灭菌处理。
②在超净台内打开过滤器,架好,胶管一端接人滤泵再插入待除菌的液体中,出口端胶管伸入到已消毒好的瓶子中。用滤泵做正压过滤。注意过滤后一定要检查滤膜是否完好无损,如发现滤膜有破损,需将液体再次除菌。
(2)合成培养基的配制
①去离子水用蒸馏器进行重新蒸馏(去除无机和有机杂质),制三蒸水。三蒸水应及时使用,如果放置一段时间,则使用前须高压处理。
②待水温降至15℃~30℃,加入合成培养基干粉,用磁力搅拌一定时间(2~4小时)使之充分溶解。
③配制RPMIl640培养基时应通人适量CO2或加入6mol/L盐酸调pH至6.0左右,这样才能充分溶解。
④加入一定量NaHCO3调节pH至7.0左右。
⑤加水至最终体积。
⑥在超净台中对溶液进行滤过除菌,分装入250ml或500ml玻璃瓶中,用翻帽塞塞紧瓶口。
⑦瓶口封好,4℃冰箱贮存(RPMIl640培养基可以-20℃贮存)。
(3)生长培养基的配制
除无血清培养之外,各种合成培养基在使用前需加入一定量的小牛血清(或胎牛血清)和抗生素。培养基分装成小瓶(100~200ml)以备使用,翻帽塞塞紧瓶口。按如下比例配制:基本培养基占80%~90%,小牛血清占10%~20%。按1%体积分数加入双抗贮存液(青霉素+链霉素),使青霉素和链霉素的终浓度分别为100U/ml和100μg/ml。
(4)D-Hanks液的配制
①称取D-Hanks试剂。
表1-18 Hanks,D-Hanks液(g/L)的成分比较(www.chuimin.cn)
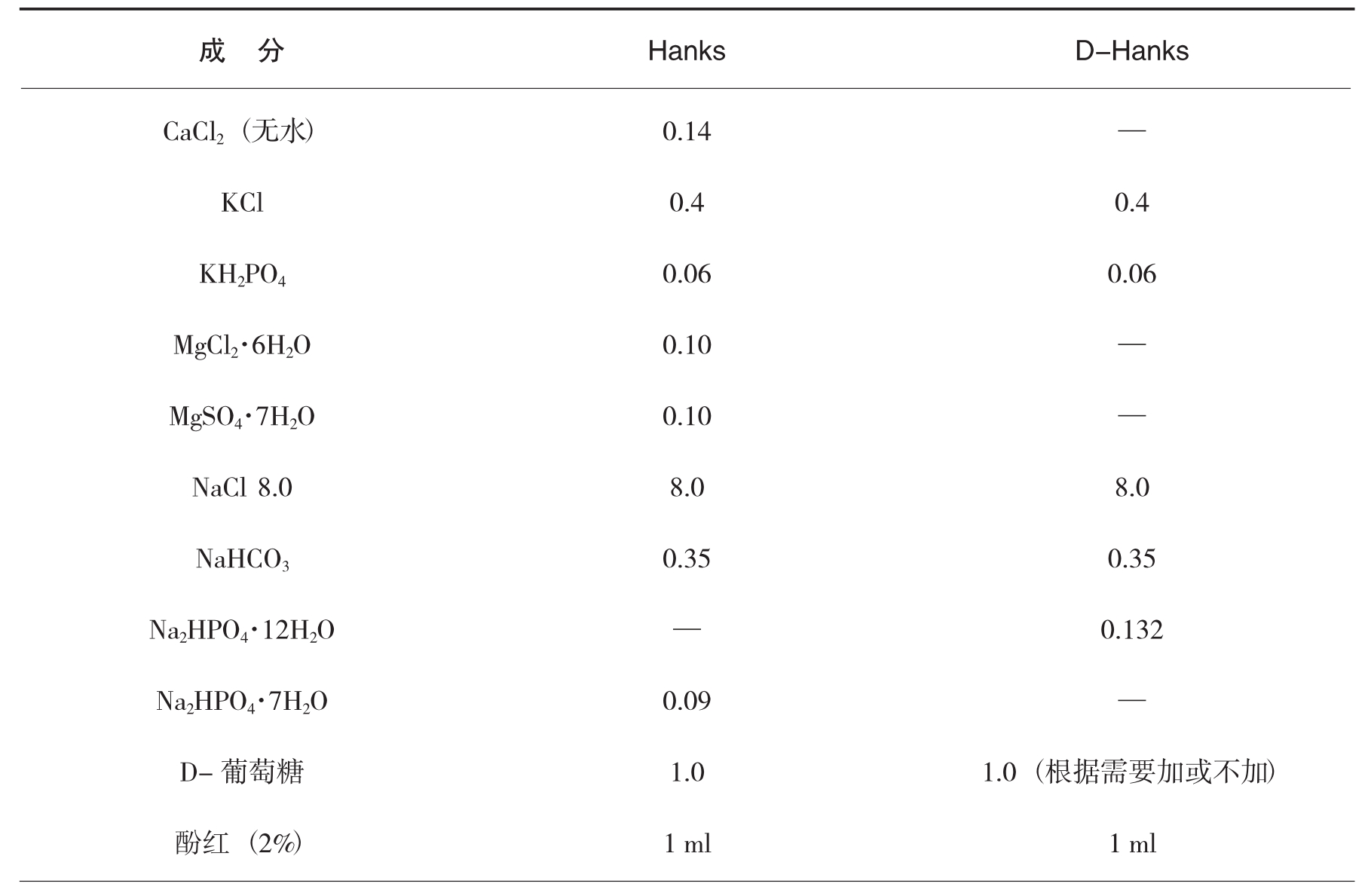
②依次加入上述试剂至800ml蒸馏水中,溶解后定容至1000ml。
③高压灭菌。
(5)Hanks液的配制
①按表1-18称取Hanks试剂。
②配制Hanks时,需将CaCl2另溶解于100ml的蒸馏水中。
③依次加入上述试剂至700ml蒸镏水中,溶解后再与CaCl2溶液一起定容至1000ml,高压灭菌。
(6)胰蛋白酶消化液的配制
①D-Hanks液高压灭菌之后,晾至室温,4℃保存备用。
②称取一定量胰蛋白酶粉末于研磨器中(夏天时研磨器应放在冰浴中),加入少量D-Hanks液研磨1000次左右,调制成糊状。再放人4℃预冷的适量D-Hanks液中,4℃下磁力搅拌使完全溶解。
③用NaHCO3干粉将胰酶溶液的pH值调至8.0左右(胰酶作用的最适pH值),并加入0.02%EDTA以协助消化作用。
④滤过除菌,-20℃冻存。
6.注意事项
(1)培养细胞所用的瓶子和饭盒应与提取RNA和培养细菌的瓶子和饭盒严格分开。因为用于处理提取RNA的DEPC水(0.1%焦炭酸二乙酯)是一种致癌剂,可能影响细胞生长。
(2)过滤时压力注意不要过大,否则细菌容易通过滤膜则达不到除菌效果,或因压力过大使滤膜破裂,从而使细菌通过滤膜。
(3)分装量为使用3~5次用完为宜,并且每瓶只能装2/3体积的液体。这是因为在高压灭菌时,如果液体过多,将会导致瓶子易爆或胶塞自喷。
(4)滤器用毕后应立即刷洗,经蒸馏水洗涤后,晾干收藏。
(5)BSS的pH值应为7.2左右。
(6)配制Hanks液,可将CaCl2与含有其他成分的液体分别装瓶高压灭菌之后,再在无菌条件下配制,定容,以避免高压灭菌后液体变混。
(7)胰酶受热易失活,所以尽量避免盛夏配制,并且在配制过程中温度应始终保持在4℃左右。胰酶分装时尽量分装成小瓶,并遵守3次左右用完和只装2/3体积的原则。尽量缩短胰酶在0℃以上停留的时间,以保持胰酶的消化能力。
7.思考题
(1)为什么配制培养基之前要反复处理配制用水并要事先高压处理?
(2)血清在细胞培养中有何作用?
(3)配制培养基时调节pH值的目的是什么?
(4)配制胰酶消化液时应注意哪些问题?
(5)D-Hanks和Hanks液的成分和配制方法有什么主要区别?
有关生物技术制药实验的文章

水是最常用的溶剂,配制试剂、标准物质、洗涤时均需大量使用。市售蒸馏水或去离子水必须经检验合格才能使用。实验室中应配备相应的提纯装置。其电阻率约0.5MΩ cm,适用于配制一般定量分析试剂,不宜用于配制分析重金属或痕量非金属试剂。但应注意保存,一旦接触空气,在不到5min内可迅速降至2MΩ·cm。自然曝气夏季约需1d,冬季需3d以上,如急用可煮沸、搅拌、曝气并冷却后使用。......
2023-11-23

这是因为溶剂的纯度对反应的速率、反应后产物的产率和纯度有影响。因此,了解常用有机溶剂的性质及其纯化方法,是十分必要的。目前市售三级纯正己烷含量为95%。由于甲苯比苯容易磺化,用浓硫酸洗涤时温度应控制在30℃以下。若含水量低于0.1%,亦可用3A或4A型分子筛干燥。初步脱水常用生石灰为脱水剂。......
2024-03-02

实验二十三动物细胞培养器皿的清洗与灭菌1.实验目的学会细胞培养的各种器皿的清洗与消毒。体外培养细胞所使用的各种玻璃或塑料器皿对清洁和无菌的要求程度很高。细胞培养的好坏直接与细胞培养器皿清洗的彻底与否有很大关系。③干热灭菌主要用于玻璃器皿的灭菌。将用于细胞培养的器皿放入干燥箱内,加热至160℃,保温90~120分钟。用于RNA提取实验的用品则需180℃,保温5~8小时。......
2023-12-07

糖蜜的残糖量达50%,每吨原料加入20kg即可大大促进乳酸菌发酵,效果显著。瑞典、美国、英国等国家在青贮时添加甲醛和甲酸。为了避免青贮饲料因加入H2SO4引起矿物质营养障碍,可用石灰水中和后再饲喂动物。......
2023-12-05

实验室中所用的试剂应根据实际需要合理选用,按规定浓度和需要量正确配制。由于各种原因,有时需对试剂进行提纯和精制,以保证分析质量。质量高于一级品的高纯试剂目前国际上也无统一的规格,常以“9”的数目表示产品的纯度,在规格栏中标以4个9、5个9、6个9等。4个9表示纯度为99.99%,杂质总含量不大于0.01%;5个9表示纯度为99.999%,杂质总含量不大于0.001%;6个9表示纯度为99.999 9%,杂质总含量不大于0.000 1%,依此类推。......
2023-11-23

由于镍硼中间合金的配制工艺比其他中间合金复杂,故本书在此作为实例详细介绍给读者。硼酐易吸收空气中的水分而变成硼酸,故它冷至室温时,应立即储存在密闭的容器内备用。炼硼的方法及工艺1)熔炼用熔炉(坩埚)。③在坩埚口部上盖一石棉板并在其上放压铁的作用是密封坩埚,防止外界空气进入坩埚内,以免氧化镁粉和高温下生成的硼。......
2023-06-26

(一)干草营养价值干草中蛋白质含量范围为7%~20%,粗纤维含量为20%~30%,胡萝卜素含量为5~40 mg/kg,维生素D含量为16~35mg/kg。而在能量方面,由豆科牧草、禾本科牧草及禾本科作物调制的干草之间没有显著差异,消化能约在10MJ/kg。......
2023-12-05
相关推荐