与传统媒体推出数字报刊、延续新闻信息传播的传统不同,我国原生新媒体从人际交流起家:丁磊看到互联网蕴藏的巨大商机借钱创办网易,为普通民众提供电子邮件等服务;同样看到网络商机的汪东兴、汪延等人则主攻网络论坛,为普通民众打造在线交流空间,等等。原生新媒体如何演变,继而如何影响普通人日常生活,乃至整个社会的信息传播结构等,相关问题研究才刚刚开始,未来具有很大研究空间。......
2023-11-25
实验二十一植物原生质体融合
1.实验目的
(1)学习植物原生质体和体细胞杂交的一般方法。
(2)了解细胞杂交的基本程序。
2.实验原理
原生质体是去除了细胞壁的细胞部分。利用纤维素酶和果胶酶消化植物细胞壁,从而能获得大量原生质体。聚乙二醇(PEG)高钙高pH融合诱导方法是体细胞杂交的主要方法之一。PEG带有微弱极性的负电荷,能与水、蛋白质和碳水化合物等带有正电荷基团的分子形成氢键。当PEG分子链足够大时,在邻近原生质体表面之间起着分子桥梁的作用,使原生质体能紧紧粘连成团。Ca2+可在蛋白质或磷脂负电荷基团和PEG之间形成桥梁,加强原生质体之间的粘连作用,10mmol/LCaCl2·2H2O能完全消除烟草原生质体表面的电荷。在洗涤过程中,直接或间接与质膜结合的PEG分子可从原生质体表面洗脱,并随着pH的降低,导致膜电荷的不平衡和发生重新分布。质膜紧密接触区域的电荷重新分布,可使一种原生质体上的某些正电荷基团与另外一种原生质体上的负电荷基团联结;反之亦然,最后将导致不同的原生质体发生融合。融合后的细胞在培养过程中可再生细胞壁、分裂生长从而形成愈伤组织和再生植株,产生体细胞杂种植株。
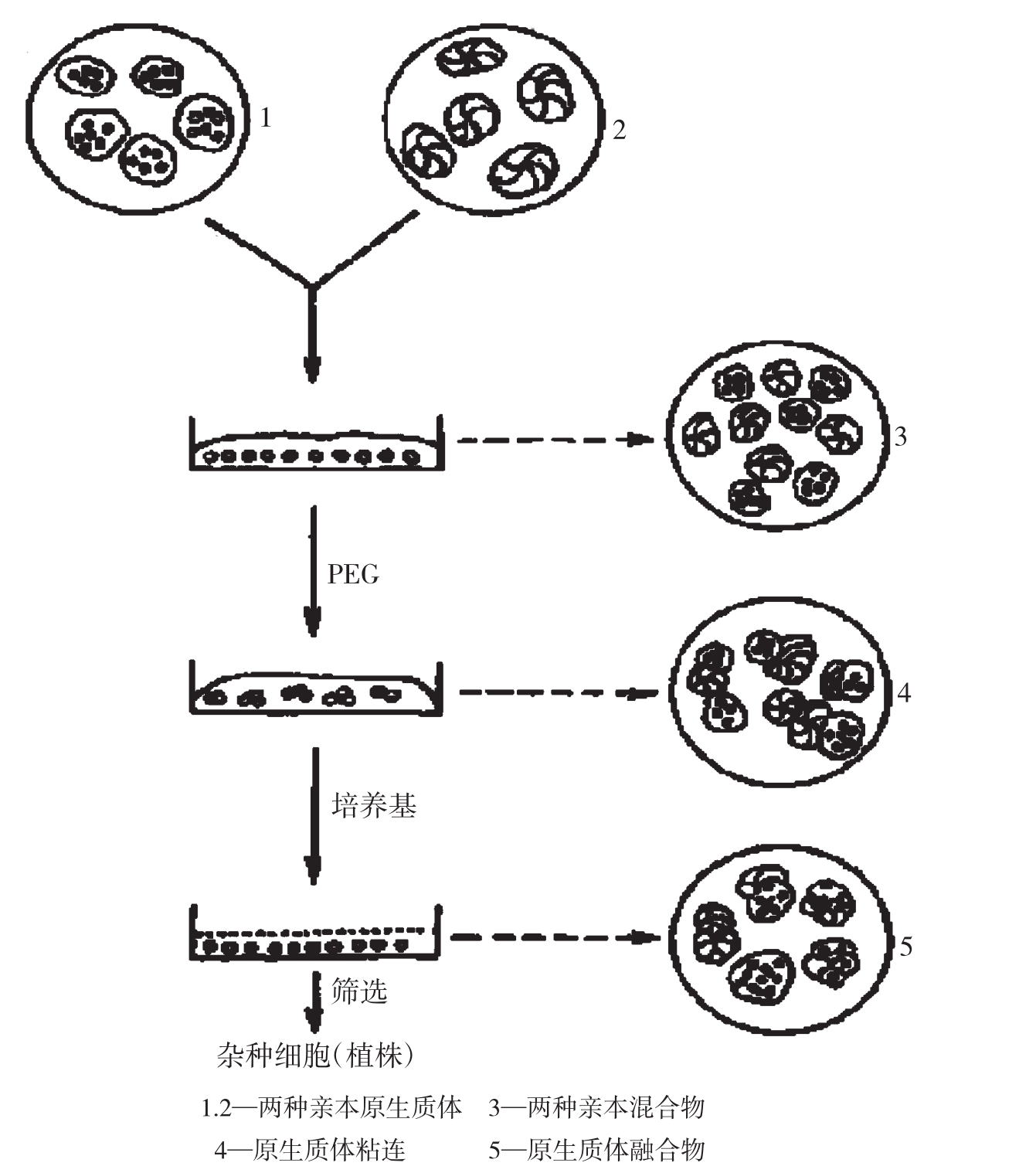
图1-14 植物原生质体融合过程
3.实验材料与试剂
(1)烟草试管苗叶片和愈伤组织
(2)D2原生质体培养基
![]()
表1-15 实验元素表

(3)MS分化培养基
MS基本培养基+0.2mg/LBA+0.01mg/LNAA+3%蔗糖+0.6%琼脂
(4)原生质体分离的酶液组成
①CPW培养基(mg/L),pH5.4
KH2PO427.2
KNO3101
CaCl2·2H2O1480
MgSO4·7H2O246
KI0.16
CuSO4·5H2O0.025
②2%纤维素酶、0.5%离析酶
③0.4mol/L甘露醇
(5)PEG融合液
①20%PEG600,0.06mol/LCaCl2,0.3mol/L甘露醇
②1mol/L甘氨酸-NaOH,pH10.0
③二甲基亚砜(DMSO)
④使用前将(1),(2)和(3)溶液按8∶1∶1比例混合
(6)W5稀释液(pH5.6)
125mmol/LCaCl2,155mmol/LKCl,5mmol/L葡萄糖
4.实验仪器与器材
超净工作台,高压灭菌锅,光照培养箱,低速离心机,倒置光学显微镜细菌过滤器(0.45μm的硝酸纤维素膜),培养皿(φ=4.5cm),解剖刀,尼龙网筛或不锈钢网筛(300目)。
5.实验步骤
(1)原生质体分离
①应用细菌过滤器过滤酶液和D2培养基(www.chuimin.cn)
②取幼叶和2~3周龄的愈伤组织,用解剖刀切成小块,按材料∶酶液=1∶10加入无菌酶液,在25℃黑暗条件下消化细胞壁4~6小时,间歇轻轻摇动。
(2)原生质体纯化
①超净工作台上过滤原生质体到10ml有盖离心管内。
②800~1000r/min离心3~5分钟,用无菌吸管吸弃酶液。沿离心管管壁加入无酶类的原生质体分离液,轻轻吸打原生质体沉淀,重新悬浮原生质体,800~1000r/min离心3~5分钟,重复2次。
③原生质体重新悬浮在少量的CPW培养基(含0.4mol/L甘露醇)中。用血球计数板在显微镜下计数和统计原生质体密度,用同样的CPW培养基调整原生质体密度到1×106/ml。
(3)原生质体融合
①将叶肉原生质体和愈伤组织原生质体等体积混合,取0.2ml原生质体混合悬浮液到另一支无菌离心管中。
②加入0.2ml新混合的PEG融合液,静置10分钟。
③在5分钟内慢慢加入5mlW5稀释液,静置1小时(切忌振动)。
④800~1000r/min离心3~5分钟,原生质体重新悬浮在稀释液中,静置30分钟。
⑤用原生质体培养液离心纯化2次,最后调整原生质体密度到每毫升105。
(4)融合细胞的观测
取一滴融合处理后的原生质体悬浮液于载玻片上或培养皿中,在倒置显微镜下观察。叶肉原生质体密布叶绿体,愈伤组织原生质体的细胞质透明,融合的原生质体中存在部分叶绿体。
(5)原生质体培养
①1ml原生质体悬浮液植板于直径为4.5cm的培养皿中,用parafilm封口,置于25℃、300lx条件下培养。
②培养2天后,原生质体为椭圆形,表明细胞壁再生。培养3~5天后,再生细胞发生第一次分裂。培养条件将光照提高到1500lx。
③培养2周后,加入0.5ml糖浓度减半的原生质体培养基。
④培养4周后,将愈伤组织转移到MS再生培养基上,诱导植株再生。进一步对再生植株进行遗传分析,鉴定体细胞杂种植株。
6.实验结果与分析
原生质体融合镜检的结果及杂种植株培养结果。
附录1:可参考的原生质体分离方法
(1)叶片放在一薄层600mmol/L甘露醇-CPW溶液中,4℃黑暗条件下预处理6~8小时。
(2)用吸管吸去预处理液,然后加入CPW盐溶液配制,经过过滤灭菌的含2%纤维素酶,0.4%离析酶,600mmol/L甘露醇的酶溶液,用封口膜将培养皿封严,置于暗处,24℃~26℃下保温酶解16~18小时。
(3)倒置显微镜下观察叶片细胞壁已降解,有圆球形原生质体释放到溶液中,即终止酶解,用吸管轻轻压挤叶片,以释放出全部原生质体。
(4)通过一个60~80μm的细胞筛过滤除去较大的碎屑,滤液置于1个螺帽离心管中,在100g下离心3分钟,使原生质体沉降。
(5)弃去上清液,将沉降物缓慢加入含有CPW配制的860mmol/L蔗糖溶液的螺帽离心管中,在100g下离心10分钟。
(6)将蔗糖溶液的顶部绿色原生质体带收集起来,并转入到另一个离心管中,在离心管中加入原生质体培养基,以使原生质体悬浮,在100g下离心3分钟,重复本项清洗过程至少3次。
(7)最后一次清洗后,加入培养基调整原生质体密度0.5×105~1×105/ml。
附录2:可参考原生质体融合程序
(1)配需要浓度的原生质体悬浮液。
(2)在直径60mm培养皿内滴一滴(2~3ml)硅液200,然后在硅液上面放一片22mm×22mm盖片。
(3)将待融合原生质体各0.5ml混合,后用吸管吸取大约150μl原生质体悬浮液置于盖玻片上,静止大约5分钟,以使原生质体沉降在盖玻片上形成一个薄层;
(4)在原生质体悬浮液中,加入等体积的PEG溶液(50%PEG1540,10mmol/LCaCl2·2H2O,0.7mmol/LKH2PO4·H2O),室温(24℃)下,将PEG溶液中的原生质体保温10~20分钟,在倒置显微镜下观察原生质体的粘连情况。
(5)以5分钟间隔轻轻加入2滴稀释液(50mmol/LCaCl2·2H2O,300mmol/L葡萄糖,pH9~10.5),保持5分钟后,加入1滴原生质体培养基。
(6)用新鲜的原生质体培养基,以各5分钟的间隔,将原生质体清洗5遍,每次洗后,不要把盖片上的培养基全部去掉,要在原生质体上留下一薄层旧培养基,而将新鲜培养基加于其上,此时可在倒置显微镜下,根据叶绿体标记统计异核融合率。
(7)洗涤完成后,在盖玻片上滴大约500μl原生质体培养基,在盖玻片周围以小滴形式再加入500~1000μl培养基,以保持培养皿内的湿度,封口后置于25℃黑暗条件下培养。
有关生物技术制药实验的文章

与传统媒体推出数字报刊、延续新闻信息传播的传统不同,我国原生新媒体从人际交流起家:丁磊看到互联网蕴藏的巨大商机借钱创办网易,为普通民众提供电子邮件等服务;同样看到网络商机的汪东兴、汪延等人则主攻网络论坛,为普通民众打造在线交流空间,等等。原生新媒体如何演变,继而如何影响普通人日常生活,乃至整个社会的信息传播结构等,相关问题研究才刚刚开始,未来具有很大研究空间。......
2023-11-25

实验十九植物愈伤组织诱导和增殖1.实验目的学习诱导植物外植体形成愈伤组织的方法。因此我们可通过改变激素种类和浓度,来有效调节植物组织培养的愈伤组织形成及器官分化。......
2023-12-07

实验六HeLa细胞与鸡红细胞的融合实验1.实验目的初步掌握动物细胞PEG融合的方法。用灭活的病毒或PEG处理细胞,能使质膜性质发生改变,使细胞膜融汇,胞质流通,导致细胞融合。细胞融合的结果,产生2类多核细胞。将上述鸡红细胞悬液及HeLa细胞悬液混合,先取出0.2ml混合液,用Hanks液稀释5倍,作为对照。......
2023-12-07

使开花能够进行的途径指调节与激活开花途径的综合因子相拮抗的抑制因子的途径,其中包括增强和降低抑制因子的活性调节。图3.1植物生命周期中生殖发育的重设、抑制和促进使开花能够进行途径的概念源自对传统生理学影响开花的光周期、自控途径和赤霉素途径单、双、三突变体的综合分析。春化作用和自调控途径的一些基因通过不同的分子机制抑制和下调FLC的表达,释放它对FT和SOC1的抑制,进而使LFY和AP1可以表达,使开花能够进行。......
2023-11-20

在Model模型中,有3种方式可以使用原生的SQL语言,下面分别进行介绍。这里所说的SQL语句是带完整数据表名的查询语言。原生的SQL语句建议只用于一些特殊的操作,因为原生的SQL语句是有一定的局限性的,比如部署多数据库应用时,需要处理各种数据库SQL语言之间的差异。此外,使用原生的SQL查询需要读者手动进行查询缓存。......
2023-11-04

观赏植物作为环境绿化、美化和香化的重要材料,在人们生活中的作用越来越受到重视。在此基础上,结合实习实训掌握常见观赏植物的识别方法,了解主要观赏植物的栽培与养护技术,为景观设计奠定基础。......
2024-01-17

经济方面,元朝的破坏可谓“罄竹难书”。北方中原地区的汉族人民最为悲惨。在中国南方,除大量人口被掳掠卖到北方做奴隶以外,当地汉族人民还要忍受与元朝上层相勾结的汉族“功臣”或投附地主的压迫。在这种情况下,自耕农的破产与逃亡,成为元代社会的常态。老皇帝忽必烈死后,元朝的通货膨胀一天比一天加剧。元朝的崩溃,很大程度上也源自这小小的片纸钞币。施行如此残暴而无人性的统治,元朝的灭亡就成为必然。......
2023-09-30

但在许多植物的果实中,三层果皮通常分辨不清,如番茄、茄子。这一特征可为识别植物提供方便,如报春花科、玄参科植物的果实成熟后,花柱和柱头仍留存在果上。2.聚花果 一个花序上所有的花,包括花序轴共同发育为一个果实,称为聚花果,如菠萝、桑、无花果。3.单果 一朵花中只有一枚雌蕊,由该雌蕊发育为一个果实,称为单果,如苹果、桃、扁豆。荚果是豆科植物特有的果实。......
2024-01-17
相关推荐