实验三质粒DNA的琼脂糖凝胶电泳检测1.实验目的了解琼脂糖凝胶电泳的原理,掌握琼脂糖凝胶的制作及进行电泳的方法。溴化乙啶染料的化学结构及其对DNA分子的插入作用。由于插入了溴化乙啶分子,在紫外光照射下,琼脂糖凝胶电泳中DNA的条带便呈现出橘黄色荧光,易于鉴定。质粒在正常情况下以cccDNA构型存在,在提取过程中由于机械力、酸碱度、试剂等的原因,可能会使DNA链发生断裂。......
2023-12-07
实验十RNA的琼脂糖凝胶检测
1.实验目的
通过琼脂糖凝胶电泳检测RNA的纯度。
2.实验原理
分离出细胞的总RNA或部分RNA之后,根据它们在电场作用下迁移速率不同,可以通过电泳来分辨不同的RNA分子,这也是检测RNA分子是否降解的关键一步。电泳是现在用于分离和纯化DNA/RNA片段的最常用技术。首先制备好“胶”,即一块包含电解质的多孔支持介质,然后将其置于静电场中,处于胶内的DNA/RNA分子在电场的作用下将向阳极移动,这是因为DNA/RNA分子沿其双螺旋骨架两侧带有富含负电荷的磷酸根残基。当DNA/RNA长度增加时,来自电场的驱动力和来自凝胶的阻力之间的比率就会降低,不同长度的DNA/RNA片段就会出现不同的迁移率。因而就可依据DNA/RNA分子的大小使其分离。
依据制备凝胶所用的原材料不同,凝胶电泳又可分成两类:琼脂糖凝胶电泳和聚丙烯酰胺凝胶电泳。聚丙烯酰胺凝胶可分离小片段DNA/RNA(5-500bp)效果最好,其分辨力极高,相差1bp的DNA片段就能分开,但其不足之处是制备和操作较为困难;而琼脂糖凝胶的分辨能力要比聚丙烯酰胺凝胶低,但其分离范围较广泛。采用不同浓度的琼脂糖凝胶可以分离长度为200bp至近50kb的DNA/RNA片段。
RNA电泳可以在变性及非变性两种条件下进行。非变性电泳使用1.0%-1.4%的凝胶,不同的RNA条带也能分开,但无法判断其分子量。只有在完全变性的条件下,RNA的泳动率才与分子量的对数呈线性关系。因此要测定RNA分子量时,一定要用变性凝胶。在需快速检测所提总RNA样品完整性时,配制普通的1%琼脂糖凝胶,取抽提的细胞总RNA进行1%琼脂糖凝胶电泳。28S、18S、5.8S三条带完整清楚,无杂带无涂抹带且28S带的宽度及亮度约是18S的2倍则说明所提RNA完整无降解。
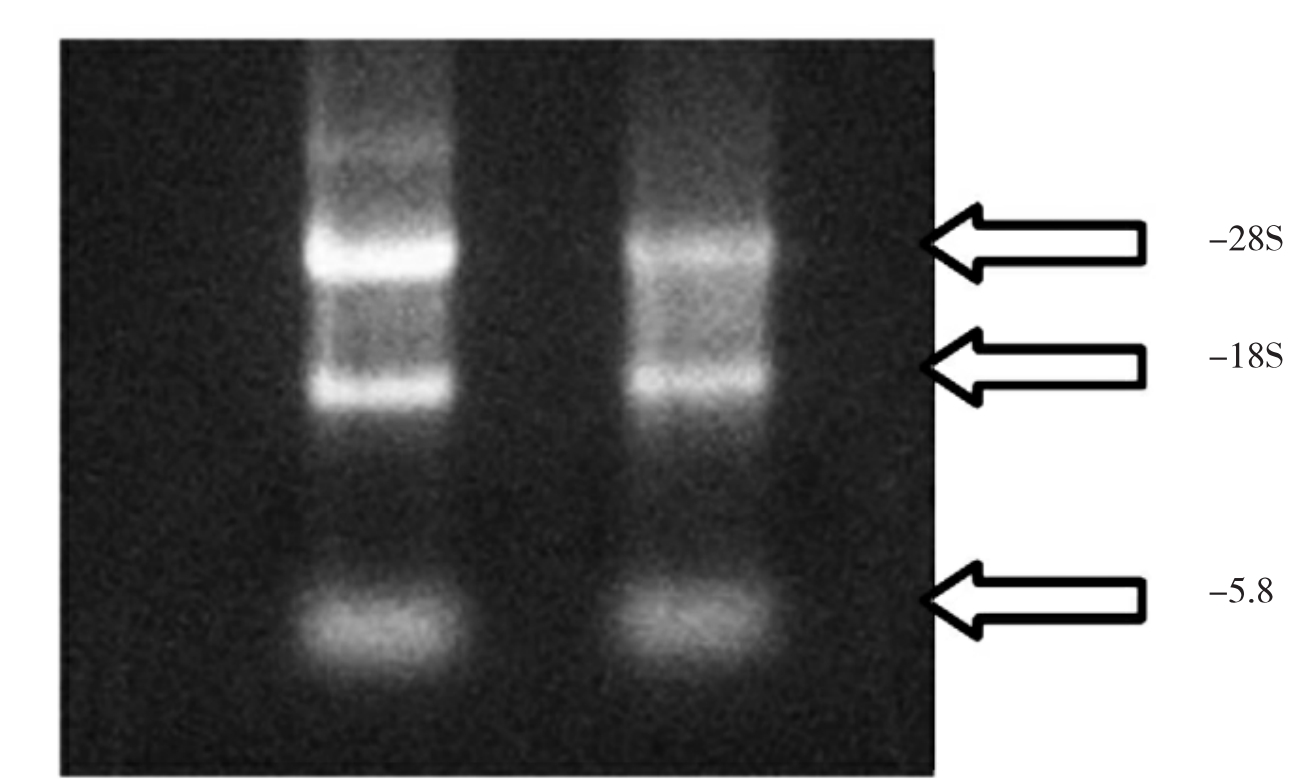
图1-9 细胞总RNA进行1%琼脂糖凝胶电泳所示条带
3.实验材料和试剂
(1)实验八中提取的RNA样品
(2)EDTA-Na2·2H2O(乙二胺四乙酸二钠盐)
(3)溴化乙啶(EB)
(4)琼脂糖
(6)冰醋酸
(7)溴酚蓝
(8)蔗糖或甘油
(9)二甲苯青FF
(10)加样缓冲液:(6×)Ⅲ型
0.25%溴酚蓝,0.25%二甲苯青FF,30%甘油水溶液,4℃保存。
(11)TAE,50×浓缩贮存液
Tris242g,冰醋酸57.1ml,100ml0.5mol/LEDTA,pH=8.0,加600ml水剧烈搅拌,定容至1000ml。
(12)0.5mol/LEDTA,pH=8.0
在800ml水中加入186.1gEDTA-Na2·2H2O,在磁力搅拌器上剧烈搅拌,用NaOH调节溶液的pH值至8.0(EDTA-Na2·2H2O在溶液pH值接近8.0时,才能完全溶解),然后定容至1 L,分装后高压灭菌备用。)
(13)溴化乙啶贮存液(10mg/ml)
在100ml水中加入1g溴化乙啶,用磁力搅拌器搅拌几个小时,然后转移至棕色瓶中,4℃贮存。
4.实验仪器
电泳仪,电泳槽,天平,磁力搅拌器,pH计,微量移液器,紫外检测仪或紫外灯,各种玻璃器皿(各种规格烧杯、容量瓶及广口瓶),紫外防护镜。
5.实验步骤
(1)50×TAE的稀释:如制备50ml1×TAE,取1ml50×TAE加入49ml水定容至50ml。
(2)制备1%的琼脂糖胶液:取0.2g琼脂糖溶于20mlTAE中,在短时间里加热琼脂糖全部熔化,使溶液冷却至60℃,加入浓度为10mg/mL的EB2μl,使EB的终浓度为1μg/ml。
(3)用于RNA电泳的电泳槽用去污剂洗干净,再用水冲洗,用乙醇干燥后灌满3%的H2O2溶液,于室温放置10分钟,然后用DEPC水冲洗电泳槽,梳子同样处理。
(4)用胶带封住胶床,放好梳子。(www.chuimin.cn)
(5)将温热琼脂糖倒入胶床中,凝胶的厚度在3~5mm,凝固20~60分钟。
(6)在凝胶完全凝固之后,小心移去梳子和胶带,将胶床放在电泳槽内,加样孔一侧靠近阴极(黑极)。
(7)向电泳槽中注入适量的TAE缓冲液,通常缓冲液高于胶面1cm。
(8)分别将RNA样品与加样缓冲液混合,(10μlRNA样品+2μl6×加样缓冲液),用微量移液器将12μl样品加入加样孔。
(9)正确连接电泳槽和电源,设定稳压为75V,电流一般为50mA。
(10)电泳结束后,在紫外观测仪上进行观察,可以看到提取完整的RNA共有三条带,分别是5kb的28SrRNA,2kb18SrRNA及0.1~0.3kb的5.8SrRNA及tRNA,可以看到28S rRNA的含量约为18SrRNA含量的2倍,说明总RNA完整性良好,无降解。
6.注意事项
(1)影响泳动的四大因素:
①影响泳动的首要因素是电泳样品的物理性质:包括电荷多少、分子大小、颗粒形状和空间结构。一般来说颗粒带电荷的密度愈大,泳动速率愈快;颗粒物理形状愈大,与支持物的摩擦力越大,泳动速率越小。即泳动率与颗粒的分子大小、介质黏度成反比;与颗粒所带电荷成正比。
②支持物介质:DNA的凝胶电泳常使用两种支持材料:琼脂糖和聚丙烯酰胺凝胶。通过这两种介质的浓度变化调整所形成凝胶的分子筛网孔大小,分离不同分子量的核酸片断。琼脂糖的孔径大,可以分离长度为100bp至60kb的核酸片断;聚丙烯酰胺凝胶的孔径小,可分离小片断(5~50bp)的核酸。
③电场强度:电泳场两极间单位支持物长度的电压降即为电场强度或电压梯度。电场强度愈大,带电颗粒的泳动率愈快,但凝胶的有效分离范围随电压的增大而减小。在低电压时,线性DNA分子的泳动率与电压成正比。一般凝胶电泳的电场强度不超过5V/cm。
④缓冲液离子强度:缓冲液是电泳场中的导体,它的种类、pH值、离子浓度直接影响电泳的效率。Tris·Cl缓冲体系中,由于Cl-的泳动速度比样品分子快得多,易引起带型不均一现象,所以常用TAE、TBE、TPE三种缓冲体系。缓冲液的pH值直接影响DNA解离程度和电荷密度,缓冲液pH值与核酸样品的等电点相距越远,样品所携带电荷量越多,泳动速度越快。核酸电泳缓冲液,常采用偏碱性或中性条件,使核酸分子带负电荷,向正极泳动。缓冲液的离子强度与样品泳动速度呈反比,电泳的最适离子强度一般在0.02~0.2。
(2)指示剂
电泳过程中,常使用一种由颜色的标记物以指示样品的迁移过程。核酸电泳常用的指示剂有两种:溴酚兰——呈蓝紫色;二甲苯青——呈蓝色。溴酚兰的分子量为670Da,在不同浓度凝胶中,迁移速度基本相同,它的分子筛效应小,近似于自由电泳,故普遍用作指示剂。二甲苯青的分子量为554.6Da,携带的电荷量比溴酚兰少,在凝胶中迁移率比溴酚兰慢,常用于聚丙烯酰胺凝胶电泳,也有溴酚兰和二甲苯青混合应用。指示剂一般加在上样缓冲液中,为了使样品能沉入胶孔,还要加入适量的蔗糖、聚蔗糖400或甘油以增加比重。
(3)染色剂
核酸经过染色才能显示带型,最常用的是溴化乙啶染色法。溴化乙啶(EB)是一种荧光染料,这种扁平分子可以嵌入核酸双链的配对的碱基之间,在紫外线激发下,发出红色荧光。激发荧光的能量来源于两个方面,一是核酸吸收波长为260nm的紫外线后能将能量传送给溴化乙啶,二是结合在DNA分子中的EB本身,主要吸收波长为300nm和360nm的紫外线的能量,来源于这两方面的能量,最终激发EB发射出波长为590nm的可见光谱红橙区的红色荧光。EB-DNA复合物中的EB发出的荧光,比游离的凝胶中的EB本身发出的荧光强大10倍,因此不需要洗净背景就能清楚地观察到核酸的电泳带型。通常,在凝胶中加入终浓度为0.5μg/ml的EB,可以在电泳过程中随时观察核酸的迁移情况,这种方法使用于一般性的核酸检测。
由于EB见光易分解,故应存棕色瓶中于4℃条件下保存。单链DNA、RNA分子常存在自身配对的双链区,也可以嵌入EB分子,但嵌入量少,因而,荧光较低,其最低检测量为0.1μg。
(4)溴化乙啶是强诱变剂,有中度毒性,可致癌,使用这一染料时务必戴上手套。
7.思考题
(1)加样缓冲液的作用是什么?
(2)琼脂糖中加入EB的作用是什么?
附录
溴化乙啶溶液的净化处理:
(1)溴化乙啶浓溶液(浓度>0.5mg/ml)的净化处理:
①加入足量的水使EB的浓度降低至0.5mg/ml以下。
②加入1倍体积的0.5mol/LKMnO4,小心混匀后再加1倍体积的2.5mol/LHCL,小心混匀,于室温放置数小时。
③加入1倍体积的2.5mol/LNaOH,小心混匀后可丢弃该溶液。
(2)溴化乙啶稀溶液(如含0.5~1μg/ml溴化乙啶的电泳缓冲液)的净化处理:
①每100ml溶液中加入100mg粉状药用炭。
②于室温放置1小时,不时摇动。
③用滤纸过滤溶液,丢弃滤液。
④用塑料袋封装滤纸和药用炭,作为有害物予以丢弃。
有关生物技术制药实验的文章

实验三质粒DNA的琼脂糖凝胶电泳检测1.实验目的了解琼脂糖凝胶电泳的原理,掌握琼脂糖凝胶的制作及进行电泳的方法。溴化乙啶染料的化学结构及其对DNA分子的插入作用。由于插入了溴化乙啶分子,在紫外光照射下,琼脂糖凝胶电泳中DNA的条带便呈现出橘黄色荧光,易于鉴定。质粒在正常情况下以cccDNA构型存在,在提取过程中由于机械力、酸碱度、试剂等的原因,可能会使DNA链发生断裂。......
2023-12-07

实验类型 综合性教学时数 6操作视频一、实验目的掌握从大肠杆菌中制备质粒DNA的方法,提供实验所需载体。了解琼脂糖凝胶电泳的原理和应用范围,掌握琼脂糖凝胶电泳分离DNA的方法。提取质粒DNA也是基因工程中最常见的实验操作。琼脂糖凝胶电泳是在电场作用下,利用琼脂糖的分子筛效应,使DNA分子从负极向正极移动。......
2023-11-04

实验八真核细胞总RNA的提取1.实验目的掌握真核生物细胞基因组RNA制备及定量的基本方法。由于细胞内大部分RNA是以核蛋白复合体的形式存在,所以在提取RNA时要利用高浓度的蛋白质变性剂,迅速破坏细胞结构,使核蛋白与RNA分离,释放出RNA。再通过酚、氯仿等有机溶剂处理、离心,使RNA与其他细胞组分分离,得到纯化的总RNA。它既可破坏细胞结构使核酸从核蛋白中解离出来,又对RNA酶有强烈的变性作用。......
2023-12-07
掌握利用葡聚糖凝胶层析进行蛋白质脱盐的技术。蛋白质溶液如含有无机盐离子,可利用葡聚糖凝胶层析的方法使蛋白质与无机盐分离,效果理想。沉淀即为IgG粗品。收集滤液,用作层析脱盐样品。......
2023-11-04

RNA-Seq测序技术已成为研究基因表达的重要实验手段,比较不同样本中基因表达差异,为解决后续的生物问题提供了定量分析的依据。生物信息学科的研究工作者近年来也意识到了大数据带来的挑战,开发了一些基于云计算的分析软件,其中涉及RNA-Seq数据分析的主要有MyRNA、Crossbow等。本部分的研究即将要构建的基因差异表达分析流程就是针对RNA-Seq技术得到的原始数据进行设计和实现的。......
2023-11-21

实验九RNA浓度、纯度的测定及浓度的调整1.实验目的掌握RNA浓度及纯度的测定方法,并能根据实验需要来调整其浓度。在一定范围内,DNA或RNA的光密度OD260与其含量成正比。对于RNA,根据其在230、260、280nm下紫外吸收值A230、A260、A280,可确定其纯度和浓度。......
2023-12-07

掌握凝胶柱层析分离技术的原理。利用交联葡聚糖凝胶G 50的凝胶过滤作用,将脲酶和胰岛素分开,以FolimDenis反应检查流出液中的蛋白质。将乳胶管放下,仍继续加入上述悬液至凝胶层沉积至18cm高度即可。操作过程中,应防止气泡与分层现象的发生。某样品中含有1mg A蛋白、1mg B蛋白、4mg C蛋白、1mg D蛋白、1mg E蛋白,采用Sephadex G75凝胶柱层析,请指出各蛋白质的洗脱顺序。通过实验讨论,哪些因素会影响凝胶层析的分离效果?......
2023-11-09

密立根是著名的实验物理学家,他从1907年开始着手电子电荷量的测量研究,到1911年宣布实验的结果。密立根的实验设备简单而有效,构思和方法巧妙而简洁。OM98BCCD微机密立根油滴仪。用K2 将油滴移至某条刻度线上,仔细调节平衡电压,这样反复操作几次,经一段时间观察油滴确实不再移动才认为是平衡了。......
2023-11-02
相关推荐