实验一基因工程菌的发酵工艺1.实验目的了解基因工程菌发酵的一般工艺以及发酵过程的参数控制。应用基因工程技术改造的工程菌在发酵表达时,诱导起始菌浓度、诱导物浓度、诱导时间等对其也会产生影响。在火焰保护下拔下瓶塞,将菌种液小心迅速倒入发酵罐,盖上接种盖并拧紧、灭火焰,用酒精棉擦洗接种口周围。......
2023-12-07
实验五PCR扩增特异基因片段
1.实验目的
学习PCR体外扩增的基本原理;掌握PCR的基本操作;了解引物设计的一般原则。
2.实验原理
PCR(Polymerase chain reaction)是一种特定核酸序列扩增技术,是分子生物学中一项极为常用的技术。
PCR的原理是在模板DNA、引物和4种脱氧核糖核苷酸(dNTP)存在的条件下,依赖于DNA聚合酶的体外酶促合成反应。两个引物分别位于靶序列的两端,同两条模板的3'端互补,由此限定扩增片段。PCR反应由变性—退火—延伸循环构成,即在高温下模板双链DNA变性,在较低温度下与过量的引物退火,再在适中温度下经DNA聚合酶催化进行延伸。每一循环的产物可作为下一循环的模板,因此扩增产物的量以指数级方式增加。理论上,经过n次循环可使靶基因扩增到2n-1,由于扩增效率很难达到100%,实际量会少些,通常经25~30次循环可扩增106倍,这个量可满足分子生物学研究的一般要求。
PCR反应中的引物设计极为重要。要保证PCR反应能准确、特异、有效地对模板DNA进行扩增,通常引物设计要遵守以下原则:①引物长度:15~25个核苷酸;②GC含量为40%~ 60%;③Tm值高于55℃[Tm=4(C+G)+2(A+T)计算];④引物与模板非特异性配对位点的碱基配对率小于70%;⑤两条引物间配对碱基数小于5个;⑥引物自身配对(特别是在引物的3'端)形成的茎环结构,茎的碱基对数不大于3。影响引物设计的因素比较多,常常利用生物软件来辅助设计。
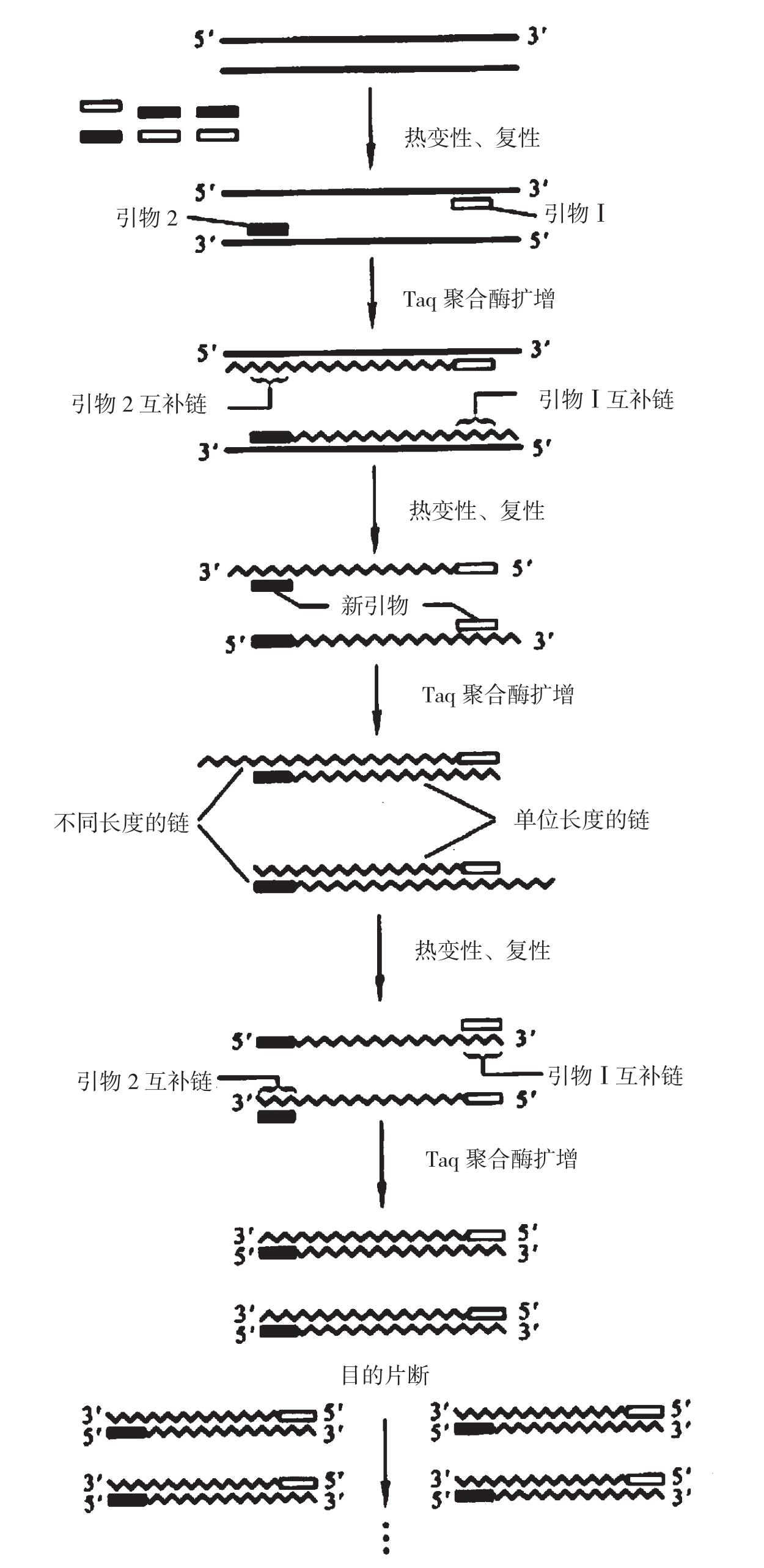
图1-7 PCR扩增DNA的原理示意图

图1-8 PCR指数扩增时循环次数与DNA产物数量的比较
3.实验材料和试剂
(1)4×dNTP:1mmol/LdATPlmmol/LdCTP
1mmol/LdGTPlmmol/LdTTP
(2)Taq酶:5U/μl
(3)模板DNA:0.1μg/μl
(4)引物:Pl:5'-TTCCATATGCCTACTTCAAGTTCT-3' P2:5'-ACCTAAGCTTGCTTCAAGTTAGTGT-3'
引物溶液浓度:50nmol/L
4.实验仪器与器材
PCR自动扩增仪、离心机、微量注射器、微量移液器、电泳仪、水平电泳槽、透射紫外观察仪、0.5ml Eppendorf管。
5.实验步骤
(1)在PCR仪上按照反应条件设置程序。
(2)取一支灭菌的0.5ml Eppendorf,按如下顺序加样:
表1-2 加样顺序表

(3)用手指轻弹Eppendorf管底部混匀溶液,然后离心2秒以集中溶液于管底。
(4)将样品Eppendorf管插在PCR仪样品板上,95℃10分钟,使模板充分变性。然后94℃45秒,55℃45秒,72℃60秒,25~35循环。(用旧式的PCR仪进行基因扩增时还要求覆盖约50μl液状石蜡,改进后的PCR仪不需液状石蜡覆盖。)
(5)取5μlPCR反应液及1μl上样缓冲液混合,进行琼脂糖电泳(5V/cm),选择适当大小的DNA分子量标准(DL2000),检查扩增产物。紫外观察,必要时拍照。(www.chuimin.cn)
6.注意事项
(1)在进行PCR前,模板的纯化和引物设计尤为重要。
(2)Mg2+对Taq DNA聚合酶的活性影响很大,PCR时注意Mg2+的浓度。
7.思考题
(1)PCR中引物和TaqDNA聚合酶各有什么作用?
(2)如何预防PCR中出现的假阳性结果?
(3)引物设计应遵循什么原则?
附录
一、PCR引物设计
1.Tm值Tm值是PCR引物设计中的一个重要参数,是指引物与模板之间精确互补并且在模板过量的情况下有50%的引物与模板配对,而另外50%的引物处于解离状态时的温度,Tm值一般高于55℃。合适的引物选择应需考虑到以下因素,如Taq酶的最适温度(TE)和Tm值等。最常用的Taq酶的最适温度(TE)范围为70℃~74℃,根据TE可以先确定一个合适的退火温度范围(Ta)。这个温度范围应不高于酶的最适反应温度,也不能比TE-25℃更低。这是因为如果退火温度低于酶的最适反应温度时,酶的合成反应会非常缓慢,但片面考虑提高温度又会造成引物脱落而不能进行PCR扩增。所以Ta的选择应满足TE-25℃<Ta<TE。
2.引物的长度引物长度一般在15~30个核苷酸之间比较合适。引物过短时造成Tm值过低,不能与模板很好地配对或是配对专性很低。引物过长时又会造成Tm值过高,超过酶的最适反应温度,还使合成引物的费用大大增加。当然若要在引物的5'末端加上特定的酶切位点等碱基则可稍长。
3.引物的GC%含量引物的GC比最好设计在40%~60%的范围内。GC比过高与过低都会直接造成Tm值的过高与过低。如上所述,Tm值的估计可简单地根据经验式Tm=4×GC+2×AT+3.3℃获得。
4.引物3′端起始碱基Taq酶在3′末端错配时延伸效率是不一样的,延伸效率为T>G=C>A。即当引物3′末端为A时,即使有错配碱基也最不易延伸,所以引物设计时可将3′末端设计为A,以提高复制精确性。另一种理论是3′末端应设计为G或C,因为G和C的氢键多于A与T,能更好地与模板结合开始DNA合成,当然对错配延伸效率方面就不能苛求了。总而言之,引物的3′末端不要考虑使用T。
5.引物无发卡结构引物自身应无发卡结构。
6.两引物自身之间不能配对两引物自身不能配对是指同一对引物之间不能有配对的多个碱基,特别是在引物的3′末端。两引物间不能配对的道理与两引物本身不能配对相同,若发生这种情况会形成引物二聚体,造成扩增失败。一般引物自身配对形成茎环结构,茎的碱基对数不大于3,两条引物间配对碱基数小于5个。
7.引物的Tm值引物设计时应注意使两引物的Tm值相近,否则两个引物必然不能同时达到最佳退火温度,将会影响PCR扩增效果。能同时达到最佳退火温度,将会影响PCR扩增效果。由于影响引物设计的因素比较多,所以常利用计算机来辅助设计,通常可用primer 5.0软件或其他PCR引物设计程序来帮助设计。
二、PCR反应条件
1.PCR缓冲液常用的1×PCR缓冲液为10mmol/LTris-HCl pH8.3(常温),50mmol/L KCl,1.5mmol/LMgCl2。由试剂公司与Taq酶一起提供。
(1)[Mg2+]:Mg2+对PCR反应影响很大,因为Mg2+与引物-模板及产物的解链温度、产物的特异性、引物二聚体的生成、产物的忠实性、酶活力、产物的产量等诸多因素有关。Mg2+一般使用浓度为0.5~2.5mmol/L,必要时可以0.5mmol/L梯度间隔做Mg2+最适浓度试验。
(2)dNTP:常用dNTP浓度为20μmol/L(可用范围为20~200μmol/L)。dNTP的用量与PCR产量及产物忠实性有关,dNTP量过少时合成的产物减少。可以被Taq酶接受的经过修饰的dNTP有以下几类:dig-11dUTP、5-bromo-dUTP、biotin-11-dUTP、biotin-16-dUTP、7-deaza-dGTP和次黄嘌呤。但不是所有的聚合酶都能接受经过修饰的dNTP。
(3)[K+]:PCR反应中K+作用是增加Taq酶活力与促进引物退火,一般使用浓度是50mmol/L,但当[K+]高于50mmol/L时会抑制Taq酶活力。
(4)pH值:PCR反应中用的是Tris-HCL缓冲系统。Tris-HCL缓冲系统的特点是具有很高的温度系数(0.021pH/℃),20℃时pH为8.3的缓冲液在72℃延伸反应时,实际pH值降低至7.2。
(5)保护剂:由于PCR反应体系中蛋白的含量极低,所以加入的酶易变性,通常要加一定量的保护剂。如5mmol/L的二硫苏糖醇(DTT),100μg/ml的小牛血清白蛋白(BSA)或0.01%的明胶。加入保护剂对PCR循环数较多的扩增反应效果尤其明显。
2.模板PCR模板可以是DNA或RNA,RNA需反转录后扩增。模板可以是基因组DNA或纯化的质粒DNA,当然两者的DNA量在PCR起始模板中相差很大。每个PCR反应中加入的模板数量可在102~105分子,必要时可低至50个分子,模板的量少时可增加循环数。小于100ng的哺乳动物细胞基因组DNA(相当于约104个细胞),经30个循环,10%的反应物应能够在溴化乙啶染色的凝胶上看到一条主带。使用较大量模板时,循环数可减少;如果模板量很少,可能需要增加至45个循环反应。
3.引物浓度常用引物浓度为0.1~0.5μmol/L。随着引物浓度的降低,PCR反应的特异性提高但产物得率降低;随着引物浓度的升高,情况正好相反。
4.PCR反应中的酶Taq酶最初是从水生嗜热菌(thermus aquaticus)中分离获得,该酶的最适温度是72℃,在94℃时相当稳定,半衰期长达38分钟。由于这种酶使用最早,文献中所列各项最适反应条件都是针对此酶。
有关生物技术制药实验的文章

实验一基因工程菌的发酵工艺1.实验目的了解基因工程菌发酵的一般工艺以及发酵过程的参数控制。应用基因工程技术改造的工程菌在发酵表达时,诱导起始菌浓度、诱导物浓度、诱导时间等对其也会产生影响。在火焰保护下拔下瓶塞,将菌种液小心迅速倒入发酵罐,盖上接种盖并拧紧、灭火焰,用酒精棉擦洗接种口周围。......
2023-12-07

实验六PCR产物的TA克隆1.实验目的掌握通过TA连接克隆PCR产物的原理和方法。因大部分耐热DNA聚合酶反应时都有在PCR产物的3'末端添加一个“A”的特性,所以使用本品可大大提高PCR产物的连接、克隆效率。对克隆后的PCR产物用M13 Primers进行DNA测序。克隆时使用的InsertDNA片段尽量进行切胶回收纯化,PCR产物中的短片段DNA、残存引物等杂质都会影响TA克隆的效率。......
2023-12-07

实验十一基因芯片技术基因芯片是生物芯片的一种,由分子生物学、微电子学和计算机科学等多种学科相互交融而形成的新技术。基因芯片技术为大规模筛选药物提供了有效的手段,并能够从基因水平揭示药物的作用机理。另外,基因芯片也是诊断同种疾病不同病原体的有效手段。......
2023-12-07

实验十一RT-PCR扩增目的基因1.实验目的掌握反转录PCR的原理及实验方法。反应过程先以单链RNA的基因组为模板,催化合成一条单链DNA,我们将其称为第一链DNA。RT-PCR可使RNA检测的灵敏度提高几个数量级,使一些极为微量RNA样品分析成为可能。PCR扩增目的基因①模板DNA:以上述反转录所得的cDNA为模板,进行3-磷酸甘油醛脱氢酶基因的扩增。......
2023-12-07

实验一基因工程干扰素的制备1.实验目的学习利用基因工程技术制备干扰素的过程。早期干扰素是用病毒诱导人白细胞产生的,产量低、价格昂贵,不能满足需要。现在主要是利用基因工程技术构建基因工程菌、转化大肠杆菌并在大肠杆菌中发酵、表达来进行干扰素的大规模生产。构建基因工程菌①分级分离生产干扰素的白细胞中的mRNA,得到高活性的12SmRNA。......
2023-12-07

实验八真核细胞总RNA的提取1.实验目的掌握真核生物细胞基因组RNA制备及定量的基本方法。由于细胞内大部分RNA是以核蛋白复合体的形式存在,所以在提取RNA时要利用高浓度的蛋白质变性剂,迅速破坏细胞结构,使核蛋白与RNA分离,释放出RNA。再通过酚、氯仿等有机溶剂处理、离心,使RNA与其他细胞组分分离,得到纯化的总RNA。它既可破坏细胞结构使核酸从核蛋白中解离出来,又对RNA酶有强烈的变性作用。......
2023-12-07

实验六动物药物卵磷脂制备1.实验目的学习脂类药物的制备方法。磷脂类药物在临床上应用的主要有卵磷脂及脑磷脂,二者都有增强神经组织及调节高级神经活动作用,又是血浆脂肪良好的乳化剂,有促进胆固醇及脂肪运输作用,临床上用于治疗神经衰弱及防止动脉粥样硬化。......
2023-12-07

实验二基因工程干扰素效价的测定1.实验目的掌握干扰素的效价测定方法。分子生物学及基因工程技术的发展为大量生产细胞因子类药物提供了条件,而对于基因工程生产的干扰素,需要进行干扰素效价的测定。本实验采用细胞病变抑制法进行干扰素效价的测定。常用于测定干扰素效价的细胞为人二倍体细胞株,如人胚肌皮细胞次代培养物、人羊膜细胞Wish、FL及人喉癌细胞Hep-2均可。基因工程干扰素样品96孔培养板、Tip。......
2023-12-07
相关推荐