实验类型 综合性教学时数 6操作视频一、实验目的掌握从大肠杆菌中制备质粒DNA的方法,提供实验所需载体。了解琼脂糖凝胶电泳的原理和应用范围,掌握琼脂糖凝胶电泳分离DNA的方法。提取质粒DNA也是基因工程中最常见的实验操作。琼脂糖凝胶电泳是在电场作用下,利用琼脂糖的分子筛效应,使DNA分子从负极向正极移动。......
2023-11-04
实验二碱变性法提取质粒DNA
1.实验目的
掌握提取质粒DNA的常用方法。
2.实验原理
质粒是染色体外的DNA分子,大小可为1kb到200kb。大多数来自细菌的质粒是双链、共价闭合环状的分子,以超螺旋形式存在。它是细菌内的共生型遗传因子。从大肠杆菌中分离质粒DNA方法众多,目前常用的碱变性法;煮沸法;SDS法;羟基磷灰石层析法等各方法分离是依据宿主菌株类型、质粒分子大小、碱基组成及结构等特点加以选择的,其中碱变性法既经济且收得率较高,提取的质粒DNA可用于酶切,连接与转化。
碱变性法是制备质粒DNA的最常用方法。碱变性提取质粒DNA是利用共价闭合环状质粒与线性染色质在拓扑学上的差异来分离它们,在碱性pH,DNA变性,恢复中性时,线性染色体DNA不能准确复性,与其他大分子共沉淀,而质粒DNA却可以准确复性,留在上清中。碱性下,变性蛋白是可溶的,酸性、中性下变性蛋白不溶而沉淀。几乎所有纯化质粒的方法都用到质粒DNA分子相对较小和共价闭合环状这两个特性。由于操作原因提取的质粒可有三种结构:超螺旋、开环和复制中间体(即没有复制完全的两个质粒连在了一起)
实验中在pH高达12.6的碱性条件下,染色体DNA的氢键断裂,双螺旋结构解开而变性。质粒DNA的大部分氢键也断裂,但超螺旋共价闭合环状的两条互补链不会完全分离,当以pH4.8的NaAc高盐缓冲液去调节其pH至中性时,变性的质粒DNA又恢复原来的构型,保存在溶液中,而染色体DNA不能复性而形成缠连的网状结构,通过离心,染色体DNA与不稳定的大分子RNA、蛋白质-SDS复合物等一起沉淀下来而被除去。
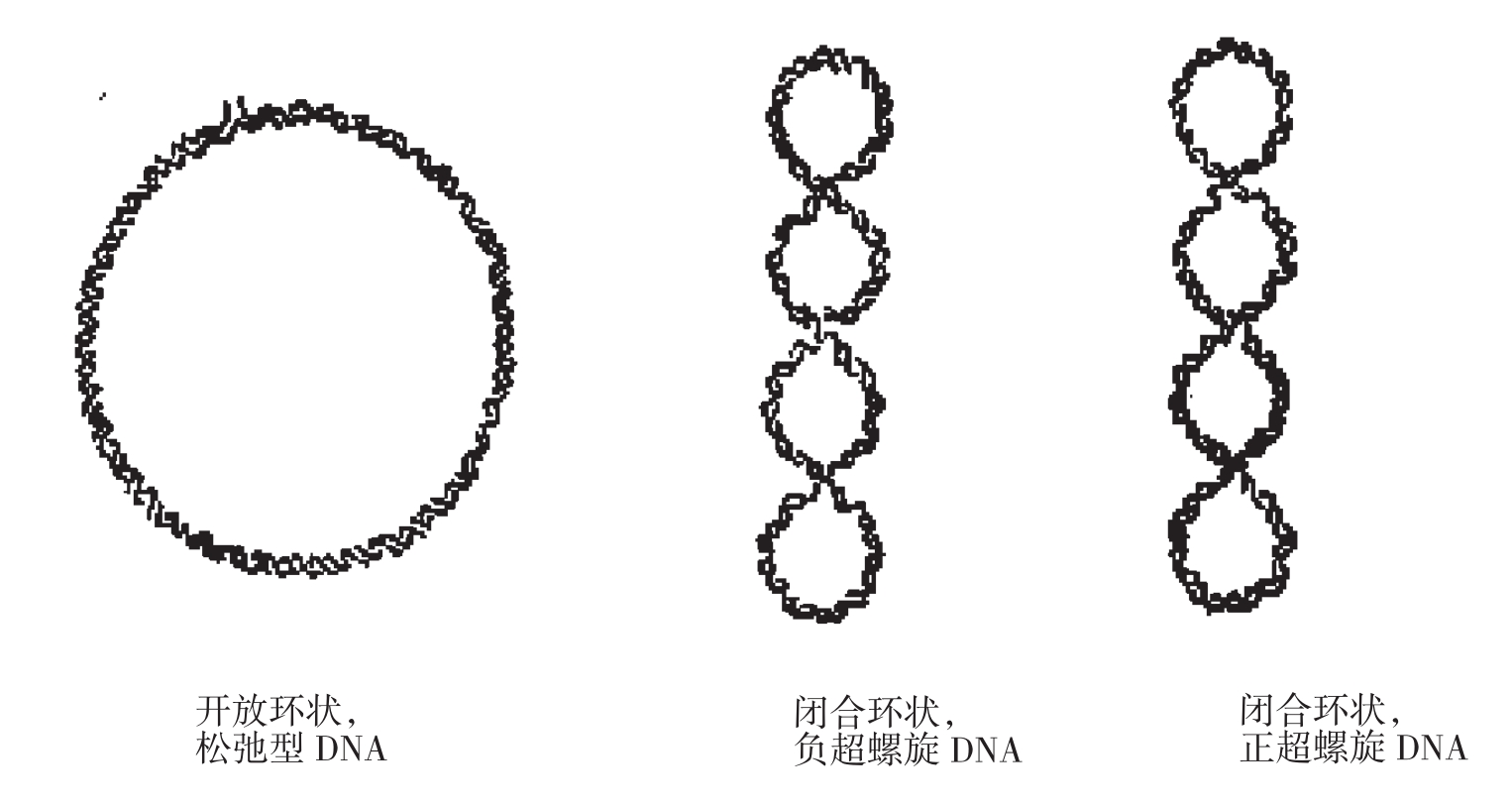
图1-1不同状态下的双链环状DNA分子示意图
3.实验材料与试剂
(1)大肠杆菌DH-5α(含pUC118质粒)
(2)LB液体培养基
胰蛋白胨(Tryptone)10g/L
酵母浸出粉(Yeast extract)5g/L
NaCl10g/L
用2mol/LNaOH调节pH至7.2~7.4,高压蒸气灭菌30分钟,4℃贮存。
(3)抗生素:氨苄青西林(ampicillin,Amp),配制成100mg/ml备用。
(4)溶液I(可成批配制,灭菌后4℃贮存)
50mmol/L葡萄糖
25mmol/LTris-HCl(pH8.0)10mmol/LEDTA(pH8.0)2mg/ml溶菌酶
(5)溶液II(最好现用现配,不需灭菌)0.2mol/LNaOH 1%SDS
(6)溶液III
3mol/LNaAc(pH4.8)溶液
(7)TE缓冲液
10mmol/LTris-HCl(pH8.0)
1mmol/LEDTA
(8)预冷的无水乙醇
4.实验器材
低温高速离心机,涡流混合器,微量移液器,接种环,1ml移液管,1.5ml Eppendorf管,200μl吸头,冰块,牛皮纸,纱布盖,线绳。
5.实验步骤
(1)挑取琼脂培养板上的含有pUC118质粒的单菌落,接种至3ml LB培养液(含100μg/ml氨苄青西林),37℃振荡培养过夜(约16h)。
自下一步骤起不需无菌操作
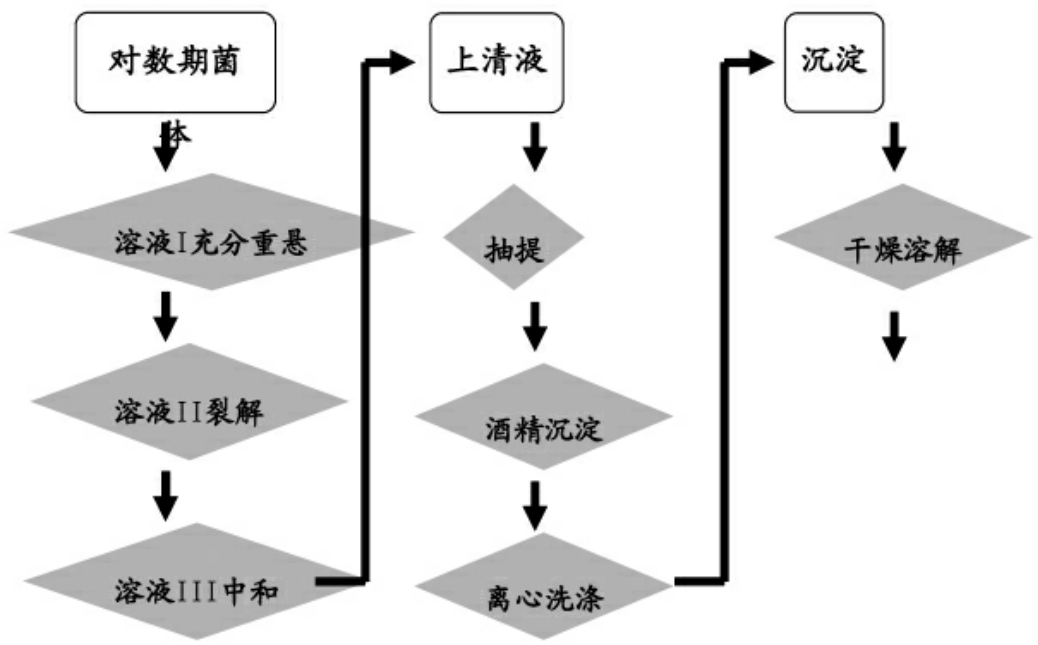
(2)取1ml菌液于1.5ml Eppendorf管中,3000r/min离心5分钟,弃去上清液。
(3)将细菌沉淀重悬于100μl预冷的溶液I中,强烈震荡混匀。
(4)加入200μl溶液II,温和振荡,溶液变黏稠,而且清亮透明,冰浴10分钟。
(5)加入150μl预冷的溶液III,温和振荡,出现白色沉淀,冰浴10分钟。
(6)4℃10,000r/min离心10分钟,将上清液小心倒入另一个新Eppendorf管中,加入800μl预冷的无水乙醇。-20℃冰箱中放置1小时,沉淀DNA。
(7)4℃10,000r/min离心10分钟,弃去上清液,将Eppendorf管中所有液体挥发干净。
(8)加入20μlTE缓冲液溶解DNA。
 (www.chuimin.cn)
(www.chuimin.cn)
图1-2 减裂解法流程图
6.注意事项
(1)去除染色体DNA是该实验成功的标志,其关键步骤是加入溶液II和溶液III时,控制变性与复性操作时机,既要使试剂与染色体DNA充分作用使之变性,又要使染色体DNA不断裂成小片段,从而能与质粒DNA相分离。这就要求试剂与溶菌液充分摇匀,摇动时用力要适当。加入溶液I时可用力振荡几次,因为此时细菌还没有与溶菌酶完全作用,染色体DNA尚未释放出来,不必担心其分子断裂。加入SDS以后,注意振荡不能过分用力,但还要保证溶液混合充分,因此可上下颠倒Eppendorf管数次,直至其混匀。
(2)加乙醇沉淀DNA时,要把离心管加盖上下颠倒摇动几次,观察水相与乙醇之间没有分层现象之后,才可以放在冰箱中去沉淀DNA,以获得更多的DNA。
(3)乙醇沉淀DNA离心后,要把离心管四周的上清液抽干或将离心管倒置于滤纸上以尽量让管内液体流出。否则,影响TE缓冲液溶解DNA。
(4)在材料准备方面:尽可能使用处于对数期的新鲜菌体,由于老化菌体将导致开环质粒增加;同时在培养时应加入筛选压力,否则菌体易污染,质粒易丢失;尽量选择高拷贝的质粒,如为低拷贝或大质粒,则应加大菌体用量;菌株不要频繁转接,否则将引起质粒丢失。
(5)在细胞裂解时要注意:使用的菌体量适当,菌体量过大将导致细胞裂解不完全,另外,离心菌体时要将培养基去除干净,加入重悬液时要保证菌体在悬浮液中充分悬浮,还要注意变性的时间不要过长(通常不超过5分钟),否则质粒易被打断,同时复性时间也不宜过长,否则会有基因组DNA的污染。
7.思考题
(1)未提出质粒或质粒得率较低,如何解决?
(2)质粒纯度不高,如何解决?
(3)简要叙述溶液Ⅰ、溶液Ⅱ和溶液Ⅲ的作用,以及实验中分别加入上述溶液后,反应体系出现的现象及其成因?
(4)简要叙述酚氯仿抽提DNA体系后出现的现象及其成因?
(5)沉淀DNA时为什么要用无水乙醇及在高盐、低温条件下进行?
(6)染色体DNA与质粒DNA分离的主要依据是什么?
附录
一、某些试剂的生化作用原理
1.溶液I—溶菌液
①溶菌酶:它是糖苷水解酶,能水解菌体细胞壁的主要化学成分肽聚糖中的β-1,4糖苷键,因而具有溶菌作用。其最适pH为8.0。
②葡萄糖:增加溶液的黏度,维持渗透压,防止DNA受机械力作用而降解。
③EDTA:螯合Mg2+、Ca2+等金属离子,抑制DNase对DNA的降解作用。另外,EDTA的存在,有利于溶菌酶的作用,因为溶菌酶的反应要求有较低的离子强度的环境。
2.溶液II—NaOH-SDS液
①NaOH:DNA在pH>5、<9的溶液中是稳定的。但当pH﹥12或pH﹤3时,就会引起双链之间的氢键解离而变性。溶液II中的NaOH浓度为200mmol/L,加到提取液中时,该系统的pH就高达12.6,因而促使染色体DNA与质粒DNA的变性。
②SDS:SDS是离子型表面活性剂。它主要功能是溶解细胞膜上的脂质和蛋白,因而溶解膜蛋白破坏细胞膜;解聚细胞中的核蛋白;SDS能与蛋白质结合成为R-O-SO3-…R+—蛋白质复合物,使蛋白质变性而沉淀下来。
3.溶液III—3mol/LNaAc(pH4.8)溶液
NaAc的水溶液呈碱性,为了调节pH至4.8,必须加入大量的冰醋酸,所以该溶液实际上是NaAc-Hac的缓冲液。用pH4.8的NaAc是为了把pH12.6的提取液调回至pH中性,使变性的质粒DNA能够复性,并稳定存在。而高盐的3mol/LNaAc可以中和核酸上的电荷,减少相斥力,有利于变性的大分子染色体DNA、RNA互相聚合而沉淀下来,同时钠盐与SDS-蛋白复合物作用后,能形成较小的钠盐形式复合物,使沉淀更完全。
4.沉淀DNA
乙醇可以任意比例和水相混溶,乙醇与核酸不会起任何化学反应,对DNA很安全,因此是理想的DNA沉淀剂。DNA溶液中DNA是以水合状态稳定存在的,当加入乙醇时,乙醇会夺去DNA周围的水分子,使DNA失去水而易于聚合。
二、某些试剂的配制方法
1.溶液I配制方法
葡萄糖0.991g
双蒸馏水80ml
250mmol/LEDTA4ml
1.0mol/LTris-HCl(pH8.0)2.5ml
用双蒸馏水定容至100ml,0.07MPa高压灭菌20分钟,4℃保存,临用时加入200mg溶菌酶。
2.溶液II配制方法
2mol/LNaOH10ml
10%SDS10ml
双蒸馏水80ml
最好现用现配,不需灭菌。
有关生物技术制药实验的文章

实验类型 综合性教学时数 6操作视频一、实验目的掌握从大肠杆菌中制备质粒DNA的方法,提供实验所需载体。了解琼脂糖凝胶电泳的原理和应用范围,掌握琼脂糖凝胶电泳分离DNA的方法。提取质粒DNA也是基因工程中最常见的实验操作。琼脂糖凝胶电泳是在电场作用下,利用琼脂糖的分子筛效应,使DNA分子从负极向正极移动。......
2023-11-04

DNA与蛋白质在生物体中以核蛋白的形成存在。向溶液中加入冷乙醇,DNA即呈纤维状沉淀出来。进一步脱水干燥,即得白色纤维状的DNA制品。为了除去DNA中混杂的RNA,可用核糖核酸酶处理。此步的目的是使DNA与蛋白质分离。用玻棒沿同一方向慢慢搅动,则DNA丝状物即缠在玻棒上,晾干即为DNA产品。......
2023-11-06

真核生物中,DNA主要存在于细胞核中,核外也有少量,如线粒体DNA,称为核外基因。DNA的分子长度一般随生物由低级进化到高级而增加。分离与提纯核酸最基本的要求是保持核酸的完整性及纯度。要从生物组织中提取DNA,因DNA以DNP形式存在于细胞核中,故首先必须粉碎组织,裂解细胞膜和核膜,使DNP释放出来,再用苯酚提取蛋白质。DNA的定量可采用化学的定磷法、定核酸法。......
2023-11-09

黄芩素的磷酸酯钠盐可用于治疗过敏、喘息等疾病。水解后生成的黄芩苷分子中具有邻三酚羟基,易被氧化转为醌类衍生物而显绿色,这是保存或炮制不当的黄芩药材变为绿色的原因。图1-12-2黄芩苷提取工艺流程二、生产工艺过程(一)黄芩的分离提取称取一定量的黄芩样品,用粉碎机粉碎,得到黄芩粗粉。......
2023-06-24

实验三质粒DNA的琼脂糖凝胶电泳检测1.实验目的了解琼脂糖凝胶电泳的原理,掌握琼脂糖凝胶的制作及进行电泳的方法。溴化乙啶染料的化学结构及其对DNA分子的插入作用。由于插入了溴化乙啶分子,在紫外光照射下,琼脂糖凝胶电泳中DNA的条带便呈现出橘黄色荧光,易于鉴定。质粒在正常情况下以cccDNA构型存在,在提取过程中由于机械力、酸碱度、试剂等的原因,可能会使DNA链发生断裂。......
2023-12-07

子任务三酱油发酵与提取酱油的发酵是利用曲中米曲霉分泌的多种酶将蛋白质和淀粉等高分子物质分解成氨基酸和糖,形成酱油的色、香、味、体。加强发酵管理,定期抽样检验酱醪质量直至酱醪成熟。发酵周期为3个月。一贯型酱醅发酵温度始终保持于42℃左右。低温型酱醅发酵温度在15℃维持30天。目的是抑制乳酸菌的生长繁殖,同时保持酱醅pH=7左右,使碱性蛋白酶能充分发挥作用,有利于谷氨酸生成和提高蛋白质利用率。......
2023-12-07

琼脂糖凝胶电泳是分离鉴定和纯化DNA片段的标准方法,可以快速分辨用其他方法所无法分离的DNA片段。2.DNA分子量标准的制备 采用Eco RⅠ或HindⅢ酶解所得的λDNA片段来作为电泳时的分子量标准。DNA存在处显示出肉眼可辨的荧光条带。......
2023-11-09

DNA的自我复制生命建筑的图纸随着医学的发展,DNA这个词汇在我们生活中出现的频率是越来越高了。对于像DNA的自我复制,以及它的自我复制过程所展示出来的生命的秘密运动等等,我们还需要进一步地去了解。DNA双螺旋结构科学家发现了一个很奇怪的现象,在DNA的复制过程之中,细胞的分裂增生都是遗传物质自我复制和分裂的结果。......
2024-07-06
相关推荐