第十章软件和信息服务外包:发展现状与中国创新能力的提升软件和信息服务外包是全球服务外包市场的主要组成部分。我国在软件和信息服务外包方面有自己的优势,发展软件和信息服务外包符合我国产业升级的要求。作为服务外包的核心,软件与信息服务外包较充分地体现了服务外包人力资本市场合约与劳务市场合约统一的特点。表10-1软件与信息服务外包分类资料来源:作者整理。2.软件与信息服务外包的模式(1 )整体项目外包。......
2023-12-05
第四章 价值链深度分解、外包网络与企业的核心能力:以医药业为例
一、研究背景
随着全球化和知识经济的深入发展,世界范围内正在经历一场生产和研发组织方式的重大变革。在R&D国际化、模块化生产、合同制造、服务外包等新型生产方式和商务模式的推动下,产业价值链在全球延展,基于价值链的全球分工体系形成,企业之间的战略关系不断加深,并为一些传统产业的发展赋予了新的组织形态。其中,医药业生产和研发组织方式的变化引起了广泛关注。
20世纪90年代是医药业发展的黄金时期,大量新药涌现使医药业大跨国公司的生产规模急剧扩张,股价大幅攀升,利润不断增长。然而,进入21世纪,全球医药业发展却面临着一系列新问题。一方面,曾经给制药巨头带来丰厚回报的创新药品的专利到期。来自美国食品药品管理局( FDA )的资料显示,2000年44种年销售额在5亿美元以上的创新药物在美国的专利保护期于2007年结束,世界范围内80%的创新药物的专利到期,而非专利药(仿制药)领域的竞争则趋于白热化。其中,美国仿制药的市场规模已由1997年的94亿美元扩大到2006年的276亿美元。2006年,美国非专利药销售额为540亿美元,占市场总额的63%,增速为22%,而品牌药销售额为210亿美元,占市场总额的37%,增速仅为5%。在这种情况下,制药业大跨国公司急需开发新药,以维持高额利润。另一方面,药品价格不断下调以及新药开发成本激增给医药企业带来了前所未有的巨大压力。据统计,1987年美国平均每个新药的研发成本为2.31亿美元,2002年增长到8.02亿美元,2004年已高达14亿美元,而近年来一个新药的全球性Ⅲ期临床试验耗资一般也要超过1000万美元。[1]由于医药大跨国公司用于新药研发的开支持续增加,加之药品审批更加严格规范,新药获准上市销售的难度加大,致使新药研发效果不理想,不少药品长期处于开发和临床实验阶段,无法进行批量生产。目前,一个创新的专利药从其发现到上市平均大约需要12年,而开发周期的延长则意味着新药上市后专利保护期相对缩短,特别是对于销量大的药品来说,每延迟1天上市就有可能造成制药企业百万美元的收入损失。一些医药企业为了降低药品开发成本、尽快收回药品开发投入,刻意夸大药品疗效,隐瞒药品的副作用,受到了政府的严厉处罚,严重影响了其产品的可信度和企业的公众形象,迫使医药企业深化新药的成分分析,开展更为全面充分的基础研发和临床测试(见专栏4-1 )。
这些新问题的出现,表明医药企业传统的发展模式受到了越来越多的制约。现代医药业属于资本和知识高度密集的行业,对医药企业生产研发组织方式变革与创新提出了更高的要求。由于新药研发耗资大、周期长、风险高,即使是拥有规模、技术和资本优势的制药业大跨国公司也难以承担高额的研发费用和巨大的投入风险,而更短的产品寿命,更严格的监管和更为激烈的临床开发竞争进一步增加了医药企业的研发成本。同时,目前很多原料药和制剂生产仍属于劳动密集、资源依赖性强的环节,对资源和环境的影响较大。在发达国家环境标准不断提高的情况下,制药巨头越来越倾向于向发展中国家转移生产加工能力,优化价值链配置,降低制造成本。可见,无论从研发环节、生产环节还是市场营销环节来看,外包是医药业发展的大势所趋。近年来,依托合同研究组织( Contract Research Organization,CRO ),医药业的研发特别是早期研发和临床测试大量外包给专业研究机构,而原料药、制剂的加工生产则大规模向印度、捷克、中国等低成本的国家和地区转移。到2008年,全球有近50%的制药公司开展了外包,外包成为医药企业应对全球价值链深度分解和国际竞争加剧的必然选择。
本章以医药业为例,对生产研发全球化条件下,产业价值链分解不断深化的现象做出理论解释,尝试构建基于价值链深度分解的企业外包网络,探讨外包网络的管理与企业核心能力之间的关系,并对全球医药业外包的发展态势进行分析,提出中国承接医药外包的对策。
专栏4-1
医药企业遭遇政府巨额处罚
2009年9月,美国司法部宣布,辉瑞制药有限公司就促销Bextra止痛药相关的刑事指控选择庭外和解,并将支付23亿美元作为不当营销13种药物的和解金。此次的罚款数额是美国有史以来针对不当营销处方药开出的最大罚单,也是历史上涉及金额最高的医疗保险欺诈和解案。辉瑞附属公司Pharmacia & Upjohn将支付与销售Bextra方式有关的13亿美元刑事罚款及10亿美元的民事罚款。Bextra是辉瑞近年来盈利增长的主要动力,年销售额最好时达13亿美元。遭遇刑事指控后,辉瑞在少了这一笔收入的同时,还不得不增加新开支用于该药品的撤市。作为世界最大制药商,这已不是辉瑞第一次受到政府的处罚了。在过去10年里,辉瑞曾4次面临类似情形,涉及违法营销13种药物,包括立普妥、万艾可(伟哥)等“明星”产品。2004年,辉瑞公司已就一项不当营销的刑事指控认罪,此后其业务操作就处于美国政府监督之下。美国司法部表示,辉瑞治疗精神病药物Geodon、抗生素药物斯沃( Zyvox )和治疗癫痫症药物Lyrica均存在营销不适当行为,而2009年7月,辉瑞则在另一场跨国官司中同意向尼日利亚卡诺州政府支付7500万美元赔偿金,以补偿辉瑞在尼日利亚卡诺地区进行的据称对治疗脑膜炎疗效显著的特洛芬新药试验给当地儿童造成的身体损害。
除了上述几个官司外,近年来,美国一些制药公司屡屡曝出药品违规和欺诈案:
(1 )2001年,TAP制药公司承认诱使医生为病人开其生产的药品,存在欺诈行为并导致政府蒙受损失,被罚8.75亿美元;
(2 )2003年,阿斯利康公司承认存在同样上述行为,被罚3.55亿美元;
(3 )2004年5月,辉瑞公司承认在推销镇痛药过程中有违法行为,同意交纳4.3亿美元巨额罚款;
(4 )2007年5月,珀杜药业公司承认在镇痛药“奥施康定”有高度上瘾风险的问题上误导公众,美国政府为此开出了针对包括公司及公司高管个人的高达6.34亿美元的巨额罚单;
(5 )2009年1月,礼来公司同意支付14.15亿美元罚款,用以了结因非法营销治疗精神病的药物“再普乐”而引发的民事诉讼和刑事调查。
违规和欺诈案例频发一定程度上反映出市场竞争加剧以及新药开发成本激增给医药企业带来的巨大经营压力。此次辉瑞不仅要支付23亿美元的天价罚款,而且选择和解等于辉瑞签署了“有史以来最全面的企业诚信协议” 。在被政府处罚后,由于戴上了“诚信紧箍咒” ,将迫使医药企业增加新药开发测试投入,进一步加大了医药企业的成本。
资料来源:根据http://news.stockstar.com/info/darticle.aspx?id和http://info.pharmacy.hc360.com/ 2009/09/09115389980.shtml的相关内容整理。
二、生产研发全球化与价值链的深度分解:文献评述及理论分析
毋庸置疑,全球化大大降低了世界范围内要素、商品和服务流动的障碍。从理论上讲,跨国公司可以将其生产和R&D活动安排在世界创新成本最低的地方,以充分利用各国资源禀赋和成本的差异,获得最佳生产和创新效率。对于生产和制造环节来说,跨国公司的全球一体化体系已经较为成熟完善,而在研发环节,由于R&D活动固有的溢出效应,即技术创新会产生非排他性等外部效果,使跨国公司在安排R&D活动时较为谨慎。波特认为( Porter,1990 ),将R&D活动置于海外不仅会产生巨大的交易、沟通和协调成本,而且在公司R&D活动与相关科学和生产体系之间存在着紧密的协调关系,这些外部经济增加了跨国公司在海外开展创新的惰性。同时,由于技术扩散过程中存在固有的“空间刚性” ( spatial stickiness ),即相对于价值链的其他环节,R&D环节流动性较差,即使在市场、融资和生产迅速分散的情况下,R&D活动仍可能集中在少数特定的区位。造成R&D具有“空间刚性”的原因在于创新活动特有的互动性。这种互动性是指知识或技能的转移需要在其提供方和使用方之间建立密集型的交换机制,并在一国、一个产业或一个区域内部形成技术使用的集聚效应,因而,较之生产、投资和贸易等活动,跨国R&D安排更难以实现。[2]长期以来,跨国公司R&D活动主要集中于公司内部。通常情况下,跨国公司核心技术的研发都由总部直接控制,其企业外部的R&D主要是为了适应国外市场对技术的特殊要求做一些调整和修补工作(杨丹辉,2004 )。然而,随着全球化和技术革命的深入,医药业等行业竞争环境和知识结构的变迁使其价值链上原本“刚性”较强环节的流动性增强,要求跨国公司进行研发组织创新,以适应R&D活动日益分散化和外部化的趋势。
(一)外包、创新效率与跨国公司研发组织的演变
提高创新效率是企业进行研发外包的主要动机。纵观跨国公司研发方式的演变,可以划分为三个阶段,即母公司控制阶段、研发全球化阶段和研发外包阶段,这种研发组织方式的变化是基于研发项目的复杂性、可分解性和对研发效率的追求(黄庆波、史云霞,2008 )。近年来,跨国公司的研发活动出现分散化趋势,并且研发外包的情况日益增多。即跨国公司将价值链上部分研究开发环节外包给外部企业,以达到合理利用资源、增强企业核心的目的。对这种分散化研发活动的管理,并不必然要求采取不同的模式,而完全可以通过设计合理的统一模式(如外包)进行管理,从而改善R&D项目的创新效率( Cardinal,2001 )。对于医药业来说,研发模式变革及其影响更为显著。Lim、Garnsey和Gregory ( 2006 )指出传统的企业层面的研发安排无法解释生物医药领域研发活动的新现象,医药企业利用外部机构从事研发活动的取向不断强化( Jones,2000 ),Lewi和Smith ( 2007 )也指出,医药业研发活动越来越注重研究的程序安排,也更具有市场导向,这直接导致研发活动关注的焦点由个体研究人员转向研发组织结构的塑造和改革。同时,更多的理论研究和实证分析验证了研发组织方式变革(包括外包)对企业创新效率改善的积极作用( Love 和Roper,2001;Marjit和Mukherjee,2008 ),指出研发模式创新进一步推动了医药业全球价值链治理模式的升级和整体产业组织结构的重组(贺蕾,2007 )。另一些研究注意到了外包给企业研发组织带来的风险,这种风险集中体现在复杂R&D项目协调和控制对企业操控能力的挑战等方面( Hui、David-Blake和Broschak,2008 )。
(二)制药业知识构成的变化与价值链的深度分解
医药业价值链动态发展的重要动力来自行业知识规模和结构的变化。20世纪70年代之前,药品的研发和生产主要通过化学合成的方法,当时大制药公司在行业发展中的主导地位主要表现为通过控制药品合成的分子库,进而掌握全球处方药的研发、生产和销售,而一些中小制药企业的市场份额则集中在区域生产的非处方药和仿制药(贺蕾,2007 )。20世纪70年代以来,生命科学的飞速发展改变了医药业以传统化学、物理学和病理学为支撑的知识体系。伴随着高通量筛选、联合化学、基因工程、生物技术的应用,开发新药所需的知识范围逐步扩大(曹崴,2009 )。
快速更新的知识结构主要在以下三方面推动了医药业价值链的调整:一是掌握新的专业知识的机构或企业不断加入产业链条,使得医药业价值链变粗变长,价值链的增值环节增多,可分解性提高,进而出现了价值链深度分解的现象,即在知识构成变化和要素配置全球化的推动下,价值链上研发、生产(制造)、营销等主要环节不断裂解和细分(杨丹辉,2007 );二是新知识的加入使价值链上一些环节的性质及其在价值链中的地位发生了变化,不同研发环节的战略意义出现了分化,化合物合成、筛选、临床测试等研发环节逐渐演变为非核心的、专业化的知识;[3]三是由于功能活动及其参与者的差异化、多样化导致了医药业全球价值链的片段化,因而,需要更有效的整合机制吸纳新的知识、技术能力以及不同的价值链参与者(贺蕾,2007 )。在新加入者(专业生物技术公司、学术机构等)与行业传统主导者之间形成了持续深化、日益复杂的关系,包括研发和测试外包、合同生产以及战略联盟等。在这种情况下,协调与拥有专业知识的外围企业之间的关系,成为大型制药企业应对行业知识结构变化、拓展自身知识体系的重要手段。随着研发外包的扩大,大制药企业直接雇用的科学家数量在减少,而战略管理人员却在增加(Jones,2000 )。可见,由行业知识构成变化导致价值链的深度分解已经影响到行业领导型企业战略资源的构成。
(三)全球价值链的治理
对于大制药公司这类高技术企业来说,要想维持竞争优势,必须融入全球创新网络( Jones,2000 )。在全球化时代,对全球价值链进行有效“治理”成为大制药企业维护其行业主导地位的主要方式。全球价值链(Global Value Chain,GVC )是指为实现商品或服务而连接生产、销售、回收处理等过程的全球性跨企业网络组织,涉及从原料采集和运输、半成品和成品的生产和销售,直至最终消费和回收处理的整个过程,包括所有参与者和生产销售等活动的组织及其价值、利润分配。当前,散布于全球的、处于全球价值链上的企业进行着从设计、产品开发、生产制造、营销、出售、消费、售后服务、最后循环利用等各种增值活动( UNIO,2002 )。
Gereffi ( 1999 )首次提出了“价值链”治理的概念,用以描述价值链上的权利分配关系。Gereffi、Humphrey和Sturgeon ( 2003 )将全球价值链的治理模式分为五种类型:①市场型。在这种模式下,主要通过重复交易使市场关系得以存续,交易双方更换合作者的成本很低。②模块型。提供“交钥匙服务”的供应商根据客户的要求生产产品。供应商负责采购原材料和零部件,采用通用设备,使投资最小化,并满足需求方的技术要求。③关系型。采购商和供应商之间基于高度的资产专用性,形成了相互依赖的复杂关系,甚至利用信誉、家庭或种族的联系进行治理。④领导型。这种模式中的小型供应商高度依赖于大型采购商,供应商的转换成本较大,采购方对价值链的程度力较强。⑤层级型。即实行垂直一体化的企业进行内部管理。不同全球价值链类型呈现出动态变化的趋势,这种动态变化主要由以下因素推动:一是采购商与供应商在交易过程中转移的信息和知识的复杂性,尤其是对产品和生产过程的要求;二是这些信息和知识的可编码程度。信息的可编码程度越高,转移越有效,且不需要特定交易投资;三是供应商满足交易要求的能力(见图4-1和表4-1 ) 。[4]

图4-1 全球价值链的治理模式
资料来源:根据Gereffi,G,Humphrey,J,Sturgeon,T. ( 2003 ),5-11改制。
表4-1 全球价值链治理模式的决定因素
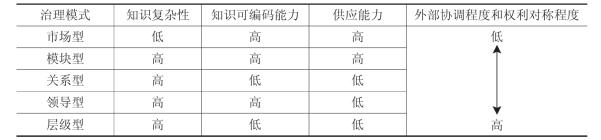
资料来源:根据陈菲琼、王丹霞: “全球价值链的动态性与企业升级”第54页改制。
随着国际竞争环境的变化,对于一些知识体系复杂的行业来说,其全球价值链升级不再是简单地按照市场型→模块型→关系型→领导型→层级型的路径进行线形升级,而是有可能形成混合型的治理架构。从行业的知识构成和市场结构来看,现代医药业全球价值链的治理便是兼具关系型、领导型和层级型的综合架构,既有关系型模式中外部关系复杂、交易和协调规模大的特征,也有领导型模式行业主导企业控制力强,并企图将外部企业锁定在价值链有限的特定环节上的特点,而且制药巨头从未放弃对企业内部分工体系的调整和完善,在其内部组织中,制药巨头在企业内部各层级之间进行隐性知识的传递,以加强核心战略资源特别是药品专利的控制。制药巨头正是通过价值链治理模式的升级创新,采取兼具关系型、领导型和层级型的混合型治理模式,实现了对行业价值链的深度拆解,并对价值链上资源进行战略重组,从而在日益网络化的任务环境中,承担着全球价值链治理者的角色。
三、外包网络与企业的核心能力
传统的跨国公司强调控制价值链从上游到下游的全部环节,直接经营所有业务,主要参与产品市场的竞争,而在全球化时代,跨国公司更注重对核心业务环节和核心资源的控制,采取各种方式,充分利用外部资源。跨国公司进行的大规模全球分包及其对外部关系的整合正是这一转变的具体体现。同时,大企业之间的竞争由产品竞争转向核心能力的竞争,跨国公司由业务多元化转向归核化( refocusing )。决定企业市场竞争力水平高低的因素不再局限于企业拥有的资源禀赋,而是更依赖于企业所独具的核心竞争能力。因此,越来越多的跨国公司选择将企业的资源投入到核心业务环节,而把一般性的、与核心能力关系弱的业务外包给其他在该业务方面具有竞争优势的企业。对于医药企业来说,生产研发外包的快速发展为企业核心能力培育赋予了新的内容。
(一)医药研发测试外包、CRO的兴起及其与制药公司的关系
自20世纪90年代中期以来,制药企业自身的创新活动已无法满足行业发展的需要,医药业的新发明和专利成果主要由学术机构或生物技术公司提供。医药研发外包需求扩大带动了合同研究组织的兴起和快速发展,合同研究组织(CRO )是指建立在合同基础上从事合作研究的独立学术性或商业性机构。CRO的雏形可追溯到20世纪70年代美国为制药业提供有限的临床前及部分临床试验服务的公立和私立研究机构。20世纪80年代,随着各国对新药研究开发管理更加严格规范,新药研发过程明显延长,成本上升,加之医疗保险费用紧缩压低了新药价格,迫使制药企业缩短新药研发周期,尽可能避免研发失败造成的巨大损失。在这种情况下,大型制药企业的研发活动开始广泛寻求外部支持,并逐步把新药的开发和临床测试外包给专门的研究机构,从而推动了CRO在美国、欧洲和日本迅速发展。CRO以合同组织为构架,接受制药企业委托的临床前研究、临床测试、数据管理、申报注册等工作和业务。
近年来,CRO在全球医药研发中发挥了举足轻重的作用。过去的15年中,制药行业几乎所有的新发现和新发明都来自学术界和生物技术公司,而不是制药企业的自主发现与发明,其中约50%的新化学个体( New Chemical Enti ty,NCE )是由小型研发公司发现的。目前,生物技术行业的年销售收入约为制药业的一半,但生物技术行业用于研发的费用占年销售收入的比重却高达50%,而制药行业这一比重还不足20%。[5]由于CRO可以通过专业人员的协作配合,提供一套完整的专业技术服务,开展跨学科的新药研制,制定实施有效、可行的研究方案,按GCP标准( “药品临床试验管理规范” ,Good Clinical Practice )组织实施临床测试,撰写临床试验报告,进行统计分析、监管服务、数据收集和产品支持等,因而,CRO的出现规范了医药研发的组织管理,大大提高了医药研发的效率。随着医药研发市场规模的扩大,CRO服务扩展到了涉及药品开发过程的各个方面。据统计,目前,合作研发外包已占全球医药研发支出的近50%,而20世纪90年代初这一比重仅为5%。其中,临床测试和研究外包支出的增长速度是制药企业自主从事研发活动的两倍,而这两类外包支出在医药业研发支出中所占的比重达25%。
从传统的管理理念来看,基础研究、新产品开发和产品测试等业务属于价值链的核心环节,也是企业核心能力的重要组成部分,这些核心环节不适合外包。制药企业一旦大量把这类业务外包给CRO,其核心能力是否会受到损害是企业和学者共同关注的问题。对于大制药公司来说,行业发展环境的变化使其不得不进行研发战略的调整。在管理愈加严格、竞争愈加激烈的环境中,既要尽可能缩短新药研究开发的时间,又必须有效地控制成本、降低研发投入的风险,而解决这一矛盾的关键,则在于如何在整个新药开发过程中,在掌控业务分解主动权与合理性的前提下,充分利用外部资源,获得高质量、高效率的研发成果。作为R&D国际化和医药行业内部分工深化的共同产物,CRO无疑是制药公司获得高质量研发成果的重要外部资源。CRO可在短时间内迅速组织起具有高度专业化和经验丰富的研发团队,大幅度降低制药企业的研发成本,这种以外包为主要运作支点的“网络研发协作”甚至被制药界和经济学家视为能使全球医药创新走出低谷的唯一方式。从制药公司与CRO之间关系来看,二者合作的基础是外包合同,虽然某些实力雄厚的CRO有可能与制药企业发展有更为紧密的战略关系,但价值链的深度分解改变了所谓核心环节的内涵和外延,一些被截断的研发活动不再独立构成企业的核心价值。由于CRO只提供研发、测试或咨询环节的某些专业服务,而不具备整合行业资源的资本和管理能力,甚至无法拥有最终产品的完整专利,因而,尽管制药公司越来越依赖CRO的专业服务,但医药业价值链的主导权仍由大制药公司掌握,而大型制药公司与CRO的关系则体现了全球化和知识经济条件下,传统纵向一体化组织的变革与演化。
(二)外包网络与医药企业的核心能力
目前,医药价值链的可分解性不断提高,价值链的分解越来越细化,而外包也随之扩展到医药业价值链的各个环节,包括早期药物发现、药理毒性测试、Ⅰ~Ⅲ期临床研究、剂型研究、配方开发、工艺改造、原料药(Active Pharmaceutical Ingredient,API,有效药用成分)和中间产品生产、药效分析测试、产品物理成型与包装设计,产品发布推广与销售支持、物流与医药企业财务管理、药物经济学分析、商业咨询与药效追踪、相关政策法规咨询。随着外包业务种类增多,外包规模扩大,作为发包企业的大制药企业将这些外包业务进行整合,实行“网络化治理” ,从而在自己的管理体系中,逐步构筑起“外包网络” ,这种外包网络以大制药企业为中心,以外包合同为纽带,在全球价值链不同环节上聚合各类CRO、中间品和制剂生产商、营销策划公司和咨询公司、律师事务所等专业服务机构(见图4-2 )。同时,医药业的外包网络也是动态的,不仅外包网络的边界是可变的,而且随着服务外包功能的扩展升级,处于网络核心的大制药企业与发包企业的关系也有可能升级,即从市场交易关系发展到战略联盟或伙伴关系,这种升级将进一步加深基于全球价值链的分工(秦仪,2007 )。
外包网络的形成将对制药企业核心能力产生怎样的影响?核心能力是1990年由两位管理科学家Prahalad和Hamel在《哈佛商业评论》上提出的,指某一组织内部通过一系列互补的技能和知识的结合,使一项或多项业务达到竞争领域一流水平的能力。核心能力具有价值优越性,异质性,难以模仿、不可交易、不可替代等特性。企业实行基于核心能力的经营管理意味着将企业的发展建立在自身所拥有的与众不同的资源之上,企业围绕这些资源构建自己的能力体系,以获得可持续的竞争优势。企业培育核心能力的途径主要有两种:一是基于产品经营的管理和组织行为;二是基于资本运作的资源整合。对于医药企业来说,外包网络建立及其管理的过程不仅与企业产品开发和生产密切相关,而且在外包网络下,通过合同关系或与供应商组建战略联盟,医药企业能够控制或接触的资源规模扩大,种类增多,使其实行战略资源重组的能力得以提高。因而,外包网络的建立和管理涉及产品经营和资本运作两个方面,是企业核心能力培育两种主要途径的集成,有利于企业核心能力的巩固和增强。
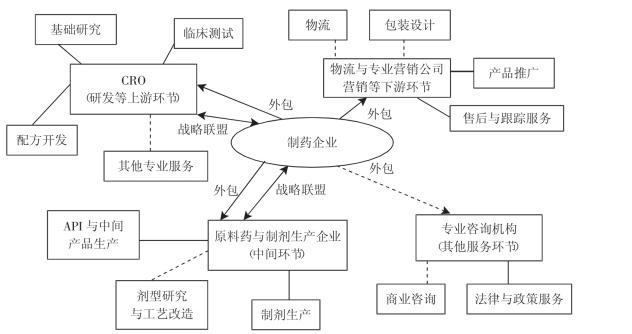
图4-2 医药企业的外包网络
注:图中实线指较为紧密的关系;虚线指相对松散的关系。
资料来源:作者自制。
同时,作为一种战略资源,外包网络本身成为企业核心能力的重要组成部分。在价值链深度分解的条件下,价值链的关键环节已不再局限于一般意义上研发、产品设计等上游环节和营销、策划等下游环节。如何分解价值链,并将截断的各环节合理整合配置到全球最有效率的区位,进而对这些分解和配置活动进行高效、网络化的治理,对于企业的竞争地位具有越来越突出的战略意义。价值链的分解和配置既可以通过传统的纵向一体化,在企业内部分工体系中完成,也可以更多地利用外部资源,通过构建外包网络实现。在这种新型组织架构下,制药企业只要能够在把握行业发展方向的基础上,控制业务分解的主动权,对企业的业务进行合理分解,选择合适的外包商,并对外包网络实行动态管理,就能够在变化的行业环境中增强企业的核心能力。外包网络不仅赋予了企业核心能力新的内容,而且使企业核心能力的构建更趋多元化(见图4-3 )。因而,由具备管理外部关系的领导型企业所控制的网络形式组织,使企业能够发掘多样性,并同时利用市场地位做出应对(曹崴,2009 )。
当然,日益庞大、复杂的外包网络也给制药企业带来了一些新的风险。首先,新药开发中发现的新化合物是医药业知识产权的核心,也是大制药企业获利的关键。对CRO药品发现和化学合成的外包有可能导致制药企业自身研发能力弱化,并对外部创新资源产生一定的依赖,而开发信息的外溢则直接威胁新药的获利能力和生命周期。其次,企业集成式发展并不会导致“管理之手”的消失,集成企业( System Integrator )的组织协调作用反而越来越大。尽管采取外包形式,但系统集成企业却需要掌握比其实际生产活动更多的知识(曹崴,2009 )。因而,外包网络必然产生一定的管理成本,这些成本主要涉及外包网络的设计、监控以及与各类接包企业和战略伙伴的沟通成本等。对于能够提升核心能力、难以模仿的外包网络,其管理成本更大。对于发包企业来说,有效率的组织协调和战略安排是化解外包网络风险和成本的重要手段。由于对CRO的管理存在信息不对称,发包企业通常难以观测到CRO从事研发的特定行动(包括研发能力和水平),因此,研发发包方可通过确定激励合同的方式,使发包企业与接包商形成利益和风险共担的机制(郝婧、龚健,2005 )。
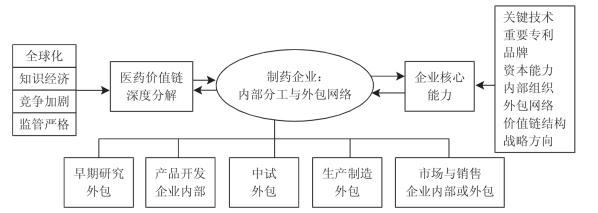
图4-3 医药产业价值链的组织架构、外包网络与企业的核心能力
资料来源:作者自制。
现实中,制药企业往往要在应对竞争加剧、研发成本上升与克服外包网络的风险和外部效果之间做出艰难的选择。因而,企业的纵向关系“往往会在一体化与非一体化之间摆动,没有发展出具有普遍意义的中间形态,能够获得市场合约和企业合约的益处。 ”[6]随着外包比例不断上升,在强化外包网络管理的同时,制药巨头凭借着庞大的规模和雄厚的资本实力,仍牢牢掌握着药品后期开发、专利经营、投资组合等更具战略价值和异质性的核心环节,这成为医药业控制全球价值链治理的关键。
(三)外包业务的管理
在对外包网络进行战略控制的前提下,制药企业还采取各种方式,对外包业务进行规范化的管理。
1.采取多样化的外包模式
医药企业构建外包网络首先要根据外包的动机,确定各类业务进行外包采取的模式,以实现业务分解和成本降低的目标。随着医药外包业务的细分化,企业对外包模式及其运作细节提出了更高的要求。以研发外包为例,目前,制药和生物技术行业的研发外包主要采取三种模式,这三种模式不仅体现了外包主体的特征,而且具有各自独特的适用范围(见表4-2 )。
表4-2 医药外包的主要模式及其适用特征
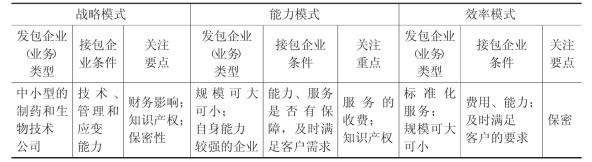
资料来源:作者整理。
2.对外包商进行严格规范的筛选
大制药公司对其外包网络的控制与管理还体现在接包企业的选择上。随着接包市场竞争的加剧,欧美企业对外包供应商的筛选越来越严格,选择的程序也逐步规范化。目前,多数大型跨国制药企业都制定了一整套选择外包供应商或服务商的审查标准,旨在保证药品的质量,维护企业声誉。根据药物生命周期的不同阶段,欧洲医药公司将外包业务分为三种类型,即医药中间体外包、原料药外包和制剂外包,结合不同类型的药物特征、相应研发阶段的工作重点、外包动机以及外包供应商与服务提供商自身的商业运作模式和实力,确定外包商的名单及相关质量和技术要求,并配合考核体系及包括供应商的生产设施、规模、高级管理层的教育水平、文化背景及外包经验等指标的细化原则,对外包供应商进行全面的考察和评估(见表4-3 )。能通过筛选和考核的接包企业将从一般供应商升级为优良供应商,其获得的订单金额、购买专业服务的深度及订单的稳定性随之大大提高,而不合格的供应商则被淘汰。从世界范围的发展趋势来看,中小型合同供应商受到了更多的青睐。中小企业的适应性和灵活性对医药发包企业有很强的吸引力,而且中小型供应商往往能提供比大型供应商更具竞争力的价格,与其沟通成本也比较低,更容易控制,因而,在外包的某些阶段,中小型接包企业具有更高的合作价值。
表4-3 选择医药外包合同商的主要步骤与标准
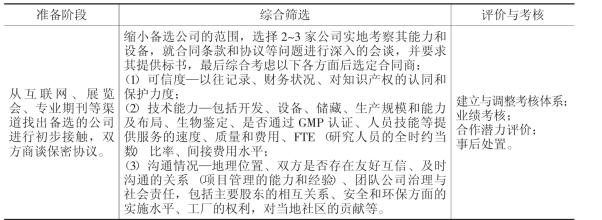
资料来源:根据吕宙翔: “世界医药外包的发展趋势及中国面临的机遇与挑战”补充整理。
四、医药外包的发展:全球趋势与中国的情况分析
近年来,医药业外包呈日益全球化和加速增长的态势,外包几乎涉及了医药业价值链的各个环节,成为外包发展最快、最受瞩目的领域之一。
(一)全球医药外包发展的新趋势
1.全球医药外包市场容量持续增长,发展潜力巨大
医药外包起步于20世纪70年代,当时的外包仅局限于小范围的临床测试,规模小且运作不规范。随着市场环境的变化和国际竞争加剧,医药外包发展十分迅速。2001年全球医药外包额为93亿美元,2005年超过了600亿美元。据Inpharm公司预测,到2010年,仅医药领域的研发外包市场将达到360亿美元。从外包市场构成来看,全球医药和生物技术外包市场规模约为350亿美元,医药业新发现、临床前开发和临床开发阶段的外包有300亿~350亿美元的市场,药品成分研究和生产阶段外包潜在市场将达到500亿美元,而剂型开发、制剂生产和包装阶段外包则面临着600亿~800亿美元的潜在市场(见图4-4 )。
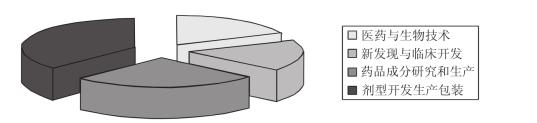
图4-4 医药外包的潜在市场规模(亿美元)
资料来源:Inpharm公司。
2.外包成为制药业大跨国公司重要的战略选择
外包使制药业大跨国公司可以专著于核心业务,充分利用外部资源,从而分散研发投入风险,加快新药面市的进程,降低成本,提高经营绩效。据统计,目前世界范围内有45%~50%的制药公司开展了外包业务。越来越多的大型制药企业与专业技术公司和生产加工企业建立了广泛的外包或合同制造关系,把生产、临床测试、研发、分析测试等业务转包出去。如辉瑞公司2007年的销售额是450亿美元,研发费用高达75亿美元,未来12~15年的研发费用预计达到800亿美元。约有350个项目正在研究开发中,这些项目主要采取外包方式,外包需求巨大。另外,2004年底,默克公司在全球减少了5100个职位,仅保留了相当于过去47%的生产岗位;2005年,礼来公司对其业务和相关机构进行了重组,扩大了外包管理部门;赛诺菲—安万特公司出售了在波多黎各和法国的加工厂,并将这些工厂的产品采取外包生产;辉瑞公司则在2008年通过外包降低40亿美元的生产成本,减少25%的本土制造能力。外包不仅使大制药公司实现了24小时不间断生产,大大提高了劳动生产率,而且通过共建CRO团队,实现了研发资源共享和创新成果的增值,进而吸引更多投资者,巩固提升了企业的市场地位。
3.医药外包的发包方主要集中在美、日等发达国家
作为制药生产离岸外包的发起者,美国制药企业成品药生产外包的发展已经比较成熟,2005年,美国占全球原料药和制剂外包市场的56%。鉴于原料药生产利润较低且环保成本高,美国在全球大量采购原料药,其采购地以欧洲国家为主,包括爱尔兰、德国、英国、荷兰、西班牙、比利时、捷克等国家和地区。近年来,印度、中国等发展中国家凭借更为低廉的成本,也开始大量承接美国制药公司的生产订单。日本也是制药生产外包发展较快的国家之一。2000~2006年,日本医药合同外包的年均增长率为19%,2006年其外包市场规模达到了3100亿日元。与欧美制药巨头相比,日本本土制药公司的规模普遍较小,日本制药工业整体增长缓慢。为尽快提升本国医药业的实力,日本政府鼓励企业开展外包。2005年4月,日本修订了《药事法》 ,允许日本制药企业对整个生产过程进行外包,同时允许企业根据需要自主决定外包的方式。这一措施使日本医药外包进入了快速发展的新阶段。2005年底,日本武田制药公司将其国内的3家生产工厂压缩成2家,并将制剂与原料药委托生产的比例分别提高到80%和75%;2006年田边制药公司将占公司生产总值20%的业务外包。但总体来看,由于日本国内对药品的质量和工艺要求非常高,一定程度上限制了供货商的选择范围。
4. CRO在医药研发外包中发挥着越来越重要的作用
近年来,CRO的价值在新药研发活动中得以充分体现,数量和规模持续扩大,外包比例提高,运营效益不断改善,已形成了较完备的技术服务体系,进入了产业化运作的阶段(见表4-4 )。其中,美国作为最大药品研发市场,其CRO营业收入到2011年预计会超过100亿美元,而按营业收入计算,欧洲CRO营业收入的年增长速度最快,2000~2010年,年均复合增长率为17.21%。临床研究是全球CRO市场中最大的服务细分市场,2008年的营业收入约为120亿美元。[7]
表4-4 世界范围内医药业CRO的发展
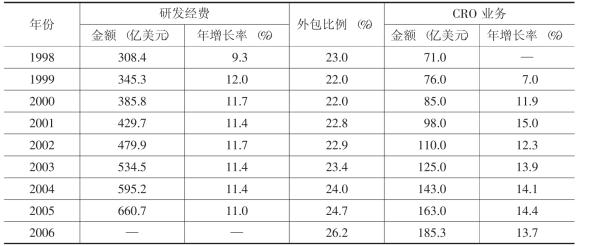
资料来源:1998~2005年的数据来自PhRMA和Frost & Sullivan;2006年的数据来自慧聪网。
从CRO市场的组织结构来看,随着制药业大跨国公司不断加快向亚太地区的产业转移,新的市场主体快速增加,目前,全球已有1100多家机构或企业参与CRO业务。在行业进入门槛降低、集中度有所下降、市场竞争呈加剧态势的同时,大型CRO公司在行业发展中仍占据突出的地位,Quintiles Transn-atiolal、Covance和MDS Pharmaceutical Services等世界排名前10位CRO公司的市场份额超过50% (见表4-5 )。再从地区分布来看,虽然美国和欧洲仍分别以约48%和29%的份额居全球CRO市场的前两位,但亚太、东欧等地区CRO公司迅速成长,这些新兴市场以其成本优势吸引了越来越多的CRO投资。其中,印度的CRO公司已经开始到美国建立分支机构,以便贴近主流市场,准确把握创新方向。竞争加剧和服务升级使CRO的服务方式日益多样化,并向制药研发的各个层面快速渗透,成为当前全球医药研发最重要的组织模式。
表4-5 全球主要CRO机构及其主要业务方向
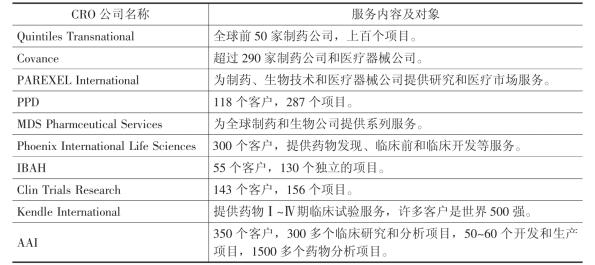
资料来源:转引自王静波: 《全球合同研发外包( CRO )服务业发展动态与趋势》 ,http: //www.istis. sh.cn/list/list.asp?id=801。
从融资渠道来看,风险投资对CRO创立和发展具有重要作用,过去5年中投向生物技术公司的风险资金占全球风险投资总规模的18%。[8]正是由于风险投资资金和私募机构在很大程度上控制着CRO的资金来源,因而,国际金融危机爆发对全球CRO的经营造成了冲击。特别是对于处于创立初期的生物技术公司来说,由于其资本运作主要依靠各类风投基金和私募基金,国际金融市场的动荡直接导致风险投资机构收紧投资。尽管生物医药业比其他行业的情况稍好,但高度依赖风险投资、主要从事临床前和Ⅰ期临床研究的中小型CRO公司面临着巨大的资金压力,其生存发展遭遇严峻挑战。美国风险投资协会( NVCA ) 2008年12月初的一项调查显示,58%的风险投资者认为,与2008年相比,生物技术领域的风险投资总额将上升或持平,但也有42%认为生物技术领域的风险投资会减少。
5.医药生产和研发外包迅速向印度、中国等新兴经济国家转移
为了降低日益增长的药品开发和制造成本,制药巨头纷纷将业务外包给印度、捷克、中国等人力资本丰富、具有成本优势的新兴经济国家。目前,世界制药巨头已将40%~50%的研发外包到发展中国家。其中,印度在承接医药外包中具有显著优势,大制药企业已将印度作为区域临床试验与研究的中心。继软件和信息工程之后,印度正在成为新药研发、临床试验和药品制造的全球外包基地。
过去10年中,印度制药业年均保持17%的高增长,远高于世界制药业7%和印度经济6%的年均增长速度,印度制药业规模已居世界第4位。印度工商业联合会的一项研究表明,2007年印度制药业的生产潜力达到480亿美元。同时,外包带动了印度制药业生产管理水平的提高。根据毕马威会计师事务所( KPMG ) 2008年10月发布的一份报告,印度有75家制药厂通过了美国食品药品管理局( FDA )的审查,是美国以外地区获得FDA批准工厂数量最多的国家。在提交给FDA的所有药物主文件( DMFs,Drug Master File )中,印度占据了46%的份额。目前,印度医药公司能生产6万多种成药,400多种大宗药物。到2010年,印度合同生产的市场规模将达到24.6亿美元,年增长率将超过40%。随着产业规模的急剧扩张,印度制药业发展的集聚效应日益凸显,带动了一批印度本土制药企业的迅速成长,在2004年《福布斯》评选出的亚太地区年收入低于10亿美元的百家最佳中小企业中,印度有太阳药业有限公司(Sun Phar-ma )、西普拉制药有限公司(Cipla )、阿拉宾度药业公司( Aurobindo )、尼古拉斯皮拉马尔药品公司( Nicholas pira-mal )等制药企业上榜,成为亚太地区进入百强最多的国家。除药品制造外,印度的医药科研也达到了世界领先水平,尤其是在生物制药及应对人类重大疾病等方面,印度相继推出了一批重大成果,引起国际社会的关注。孟买生命科技公司和国家生物科技中心被美国全国卫生研究所列为全球前10家干细胞研究机构,可享受美国政府为干细胞研发提供的联邦研究基金。据印度医药界预测,到2010年,印度医药公司的研发投入将达到5亿美元,而2015年将上升为12亿美元。
印度医药外包的快速发展是由多种因素共同推动的。一直以来,印度非常重视基础学科的教育,数学、IT、化学、生物、工程等领域积累了大量高端人才。目前,美国生物技术和制药领域10%的研究人员和15%的科学家是印度裔。除医学专业外,每年印度有12万名化学和化工本科毕业生到制药等相关领域工作,为印度医药产业的发展提供了大量高质量人才。同时,印度政府为促进经济增长、加快产业升级采取了一系列鼓励外包发展的政策措施,生命科学等高技术领域获得了政府的大力扶持,而在发展软件外包过程中,印度的知识产权保护体系日益完善,消除了大跨国公司向其外包研发和生产业务的顾虑,为承接制药业外包营造了良好的政策环境,使印度成为全球最受青睐、最具竞争力的医药外包目的国。
大量承接外包促使印度医药业迅速崛起。通过承接外包,印度医药产业不仅已经形成了规模经济和较完整的产业内部分工体系,而且其研发能力明显提高,逐步具备了较强的国际竞争力。目前,印度已不再仅局限于承接医药外包。随着其制药业综合实力的提高,印度也开始将部分原料药生产外包给中国等成本更低的国家和地区。目前,印度药品出口的质量和档次总体上要高于中国,印度在中国采购或定向加工的原料药中间体,经半合成或生产下游产品,再转销到欧美以及中国的制药企业。2007年,我国对印度原料药出口额占同期原料药出口总额的比重达到了12.1%,印度已成为我国第二大原料药出口市场。以印度为接点,全球制药业美国→欧洲→印度→中国的新型产业分工脉络日渐清晰。
6.全球医药外包市场竞争加剧
在发包市场上,一方面,制药业大跨国公司加快业务整合的同时,面对合同外包巨大的市场潜力,越来越多的制药企业开始进入这一领域。如辉瑞公司已宣布将提供合同加工服务,以利用其闲置的生产能力,百时美施贵宝公司也将实行类似的计划。另一方面,制药业的跨国并购高潮迭起,合同外包与兼并重组成为当今国际制药业两大并行的重要趋势。2005年,全球医药服务市场并购案有70起,交易总市值达到了30亿美元,交易市值分别比2003年和2004年增长了130.8%和57.9%。2006年,在产能过剩和中小企业迅速成长的促动下,美国和欧洲市场上医药合同加工企业之间的并购更加频繁,如法国的RHODIA公司将旗下CHIREX公司的业务卖给了印度的SHASUN Chemicals公司,印度的NICOLAS PIRAMAL公司购买了AVECIA公司的医药服务业务。2009年1月,辉瑞公司斥资680亿美元收购惠氏,完成了金融危机爆发后实体经济领域最大的一笔并购交易,这反映出医药业的市场组织结构处于剧烈变动之中,行业整合的态势持续增强。
而在接包市场上,中国和印度公司不仅正在成为欧美合同供应商的竞争对手,而且印度和中国之间也展开了激烈的竞争,特别是在临床实验和原料药生产方面,中国已经对印度形成了强大的追赶之势。2008年普华永道全球发布的《亚洲地区医药研发外包发展动态》指出:依据成本、风险和市场机会三项指标评估,中国已经超印度成为亚洲研发外包的首选地。该报告认为,中国凭借相关人才密集、成本低廉,受到医药跨国公司的青睐。另外,在全球医药接包市场上,俄罗斯、巴西、捷克、匈牙利也是有力的竞争者。在大规模承接外包的同时,中国和印度同样面临知识产权的问题。Ernst & Young公司对346位医药公司高管的一项调查显示,有60%的高管表示出对中国和印度外包的顾虑,包括安全、基础设施和知识产权方面的担忧。其中,62%被调查的高管认为对印度追加投资存在风险,认为对中国追加投资有风险的比例则为70%。
(二)中国承接医药外包的现状及存在的主要问题
我国承接医药外包虽然起步较晚,但凭借人力资源和制造成本优势以及相对完善的医药化工产业体系,我国开始成为制药业大跨国公司转移研发业务和生产能力新的热点地区。
1.承接原料药外包初具规模,出口增长势头强劲
我国医药化工产业的发展基础较好,能生产1500多种化学原料药,有60多种具有较强的国际竞争力。其中,四环素盐、四环素碱、土霉素盐、土霉素碱和金霉素等原料药的产量和价格具有明显优势,国际市场畅销的“二甲胺四环素” 、 “差向四环素” 、 “去甲基金霉素” 、 “强力霉素”等系列四环素衍生物类原料药出口增长也比较快。2008年我国原料药出口额达180亿美元,占全球原料药出口总额的近30%,已成为全球第一大原料药生产和出口国(见图4-5 )。

图4-5 2004~2008年中国原料药出口额(亿美元)
资料来源:中国医药工业网。
目前,我国原料药出口很大部分是为默克、惠氏等国际制药巨头加工生产,国内有几十家企业开展原料药的外包业务。外包加工的原料药主要有:硫酸黏杆菌素(山东明治鲁抗)、头孢哌酮(大连辉瑞制药)、6—APA (阿拉宾度大同生物制药有限公司)、青霉素工业盐(张家口吉斯特—布罗卡德斯制药)、布洛芬(山东新华制药)等。这些产品外包采取定点生产并专供国外制药企业使用的方式,质量、工艺、管理等方面均按国外发包企业的要求实施。另从我国原料药外包的市场分布来看,亚洲、欧洲和北美是我国承接原料药外包的主要市场,这三大市场占我国原料药出口比重接近90%,其中,美国、印度、德国、日本和荷兰是我国原料药前五大出口目的国。为了更好地融入全球医药产业链,国内企业加快了国际认证的步伐。1980年12月,原陕西医药集团太原制药厂的甲丙氨酯(安宁,眠尔通)获得了FDA登记的DMF文件号,这是中国原料药进入美国定向采购的第一家企业(文件号现已失效)。截至2005年9月,我国企业在美国FDA登记的原料药(Ⅱ)有效文件号达到246项,获FDA登记的原料药较多的企业有浙江海正药业、上药集团、山东新华、天药集团等。近年来,我国特色原料药行业发展也非常迅速,如浙江台州地区生产的抗肿瘤药、降血脂药、抗寄生虫类等九大类原料药已打进国际市场,有61个品种相继获得FDA、COS (Certificate of Suitability,欧洲药典适用性认证)和TGA ( Therapeutic Goods Administration,澳大利亚医药管理局)等认证。
2.制剂生产外包潜力巨大
除原料药之外,全球制剂生产外包市场也开始向中国医药企业敞开大门。我国药品制剂的生产技术比较成熟,控缓释技术、靶向制剂、透皮吸收等先进技术已广泛应用,可生产西药制剂60个剂型、4500余个品种,产能居世界首位。根据中国医药保健品进出口商会统计,2003~2007年,我国西药出口迅速增长,出口额由2.5亿美元增加到7.8亿美元,年均增幅达20%以上。目前,我国已有4000多家制药企业先后投入400多亿元,通过了GMP (Good Manufacturing Practice )认证。
我国承接制剂生产外包既有压力,也有机遇。一方面,制剂生产企业普遍存在生产线开工不足、产能大量闲置的问题。2007年,国家颁布《制药工业污染物排放标准》后,在环保压力下,制药企业的开工率不足50%,行业产能过剩的矛盾更加突出。另一方面,2008年前后,全球约有销售额200亿美元的药品专利保护到期,这将使全球仿制药释放出广阔的市场空间,从而为我国制药生产企业提供巨大商机。近年来,国内一些制药企业积极开展制剂的代工业务。2005年初上海复星朝晖药业公司与丹麦药品研发公司LEO制药公司签订协议,承接抗皮肤感染药物的生产;2006年西安千禾药业也与一家英国公司签订了每年10亿粒降血压片剂的代工协议。承接外国政府及相关国际组织的政府采购也是我国扩大制剂外包规模的重要途径。如世界卫生组织以及世界各种援助组织对抗疟药、抗艾药、抗结核药等人类重大、疑难和影响面广的疾病治疗用药实行政府采购。这些订单一般首先由大跨国公司拿到,而后它们再把订购的药品外包给成本低的发展中国家制药企业。我国的海正药业就从美国礼来公司获得了两种抗击耐多种药物型结核病的专利药卷曲霉素的生产权,不仅与一家印度公司共同分享了世界卫生组织全球DOTS治疗计划中5.62亿元的资助,而且还获得了礼来公司超过100万美元的前期投入。另外,2007年,浙江华海药业股份有限公司生产的抗艾滋病药物已获得了美国FDA的认证,成为获准向美国出口成品药的首家中国企业。
3.我国承接医药研发外包前景广阔
目前,我国承接医药外包开始由“产品驱动型”的第三个阶段向“研发驱动型”的第四代加速迈进。我国拥有大批高素质且成本低廉的生物医药专业人才,药品研发成本仅为美国的一半。同时,我国临床测试的病人样本及疾病资源十分丰富和独特,新药临床试验的周期短、成本低、效率高,承接药物早期研发和临床测试外包的潜力很大。近年来,随着国内研发氛围的改善,制药巨头和国外大型CRO机构开始重视中国医药研发的能力,纷纷在中国设立研发中心。截至2007年,世界排名前20位的跨国制药公司都已在中国合资办厂,中国最大的500家外资企业中,医药企业占14家。最初外资医药企业进入我国市场只是生产和销售,而现在研发业务的比重不断提高。如罗氏制药在上海郊区的研发中心已投入使用;辉瑞将斥资1.75亿美元在上海兴建地区总部,负责监管现有的制造及营销业务,并有意计划在中国设立研发中心;瑞士诺华制药在与中国研究机构协商合作事宜,以深化双方的研发合作;礼来、赛诺非—安万特等制药业大跨国公司在华研发中心也开始运作。
配合医药跨国公司研发向中国转移的趋势,国内CRO机构快速成长。1996年,MDS在中国投资设立了中国第一家真正意义上的CRO,从事新药的临床试验业务,到2008年,中国已有400多家CRO机构,仅北京地区就集中了100多家CRO,并有30多家GLP实验室通过审查。普华永道发布的《亚洲地区医药研发外包发展动态报告》显示,2008年中国医药研发外包的CRO市场规模已达到约2.6亿美元,较之2005年2500万美元的市场规模,增长了10倍多,预计到2010年可增至4.3亿美元。(www.chuimin.cn)
随着CRO市场的繁荣发展,地方政府及国内相关部门参与医药业国际研发项目的热情也十分高涨。目前,生物医药研发服务业已成为北京的优势产业之一,进入快速成长期,年增速达30%,年收入突破50亿元,占北京生物医药产业1/6。一些城市的高新技术开发区则开始着手建立生物医药服务外包的战略联盟,在北京中关村、上海张江高科技园区这两个国内CRO企业的聚集地,组建了中国生物技术创新服务联盟(Alliance of Bio-Box Outsourcing,China,ABO )、中关村CRO联盟、浦东新区生物医药研发外包服务联盟、生物医药研发外包工作委员会等CRO的联盟,逐步成长为中国CRO的中坚力量。其中,2005年,北京市吸引和依托国内外的医药服务企业和研发机构共同组建了中国生物技术创新服务联盟( ABO ),有力地推动了北京乃至中国生物医药研发服务业的快速发展。截至2008年,ABO联盟成员已由成立之初的8家发展到了33家,整合了军事医学科学院、中国药品生物制品检定所、北京师范大学、北京生物制品研究所、国家生物医学分析中心、国家北京药物安全评价研究中心等9家科研院所,汇聚了3个国家工程中心、7个国家工程技术中心,5个已通过国际AAALAC ( “国际实验动物评估和认可管理委员会” ,AssociationforAssessmentandAccreditationofLaboratoryAnimalCare International )认证的实验室、8个已通过GLP ( Good Laboratory Practice )认证的实验室、6个GMP车间(其中2家正申请FDA认证)。ABO着重从新药研发产业链条的药物发现、临床前研究、工艺研究等环节切入,形成了基因组相关技术服务、抗体及蛋白相关技术服务、药物安全性评价、化学合成与制剂研发、内部支撑平台等五大技术解决方案。再如在上海张江药谷,2005年初成立了上海市生物医药外包服务基地和上海浦东生物医药研发外包服务中心,重点培养生物医药研发外包服务的龙头企业,将在5年内形成年产值超过20亿元的生物医药产业群,争取成为亚洲规模较大的研发外包服务中心。
CRO的发展带动了我国承接医药研发外包的能力不断提高。通过承接医药研发和测试外包,中国本土CRO得以参与到全球创新药研发链条中,从而带动了技术、智力和经验的积累,并获得学习国际化管理运作模式的机会,进而将积累的研发能力投入到创新药的自主开发中。以无锡药明康德新药开发有限公司为例,作为在纽交所上市的中国第一家CRO公司,该公司服务范围涉及化学、生物和原料药,已拥有超过100项已授权或申请中的专利成果,客户包括9家全球排名前十位的制药公司,在2009年度全国服务外包十大领军企业中,药明康德排名第8位,是上榜的唯一一家非软件和信息服务领域的服务外包企业。目前,医药外包成为中国承接外包最活跃的领域之一,承接新药研发外包业务已扩展到新药研究的各个领域和阶段,涉及化学结构分析、化合物活性筛选、药理学、药代学(吸收、分布、代谢、排泄)、毒理学、药物配方、药物基因组学、药物安全性评价和Ⅰ-Ⅳ期临床试验、试验设计、研究者和试验单位的选择、监察、稽查、数据管理与分析等。
4.国内医药企业开始关注物流、销售、财务管理、人力资本等业务外包
随着医药业价值链的深度分解,外包的理念已经被越来越多的制药企业所接受,供应链环节的外包成为医药企业整合资源、降低成本、创新管理的重要手段。在这方面,在华投资的一些制药巨头的做法起到了积极的示范作用,外资医药企业在物流、财务管理、信息化建设、人员培训与人力资本管理等业务领域开展的外包活动及其组织方式给国内企业提供了很好的参考和借鉴。近来,不少国内制药企业也开始聘请专业公司为其优化业务流程,设计外包模式。如2007年,广东民营制药企业—华南药业与一家专业咨询公司签订了两年的协议,将其OTC (非处方药)事业部外包出去,开始尝试“销售队伍的管理外包” 。此举是为了应对企业销售额持续增长对销售队伍及其管理的更高要求,利用专业销售公司的渠道和资源,为医药企业提供更符合市场需求的营销手段。依据外包协议,接包公司除了要提出涉及行政管理、日常工作、终端促销等方案,对华南药业的员工进行OTC的专业培训外,更重要的是将为发包企业提供人力资源管理支持,包括建立销售团队组织架构、制定人员考评标准、完善人员激励机制等。作为企业管理的核心环节,销售外包将面临一些新的风险,其中最大的难题是如何建立有效的监管体系,协调发包企业与接包方的企业文化差异,以保持企业销售团队的忠诚度。为此,华南药业选择了与其有长期合作关系的接包公司,并将对外包的效果进行严格的考评,考评内容包括专业OTC队伍的培养和部分药品的销量业绩增长情况等。
5.医药外包市场发育尚不充分,主要集中在低端业务
尽管我国承接医药外包发展非常迅速,但目前跨国公司在中国的外包项目仍以原料药和制剂生产为主,大都分布在产业链的低端,外包的主要动机是利用我国低成本的劳动力和制造能力。总体来看,外包业务的附加值较低,且资源消耗大,部分外包加工的药物生产环境污染严重,属于在发达国家受限或已经淘汰的产品或工艺。同时,我国原料药企业接单API和专利药外包生产的时间较短,一些产品的质量及工艺水平不稳定,企业管理制度和环保标准达不到发包方的要求。虽然我国制药企业正在积极推进相关国际认证,但不少制药企业的GMP意识淡薄。即使一些通过认证的企业也并未严格执行GMP的有关标准。如目前国外要求企业对生产环境必须进行24小时监测,而很多国内企业生产环境监测每周或每月才做一次,与国际先进标准差距较大。在取得FDA登记的DMF方面,我国也明显落后于印度等国家。截至2005年9月,我国有246项原料药获得了DMF,而同期印度、意大利、德国获得的DMF数量则分别达到了759项、457项和428项。另外,由于接包企业的素质参差不齐,部分企业为争夺订单竞相压价,直接影响了我国制药企业的信誉,破坏了市场竞争秩序。
在参与医药研发方面,我国相关机构则普遍观念滞后,经验不足。一是长期以来,我国的医药研发工作主要集中在科研院所,制药企业自身研发能力较弱,医药业的创新体系不完善,产学研脱节,市场化程度较低,造成我国一些研发机构对全球医药研发外包和国际整合的大趋势认识不到位,仍固守自主研发的理念,认为承接外包的创新层次较低,忽视参与制药巨头研发外包活动过程中的技术溢出效应以及提升科研组织管理水平的机会;二是国内制药企业实力普遍较弱,以生产仿制药为主,企业新药研发投入规模小,且主要采取内部研发的传统模式,无法支撑本土CRO快速扩张的需求;三是尽管近年来我国本土CRO成长较快,但大多数本土CRO公司缺乏专业性,规模较小,普遍存在资金缺乏、技术落后、管理不规范、知识产权保护意识淡薄、缺乏完善的制度和流程等问题,导致我国CRO机构承接研发外包的服务水平和质量不高,服务内容偏重临床测试,主要开展三类或六类药的临床研究,有的CRO公司甚至不具备开展研发活动的能力,只是为制药大跨国公司提供一些组织和公关服务,其临床试验结果的真实性和可靠性与印度等国家的CRO公司尚有较大差距。现阶段,要进入全球新药研发的高端外包市场需获得美国病理学家协会( CAP,College of American Pathologists )的认证,CAP认证需投入大量资金和时间,全球通过CAP认证的实验室大部分都在美国,中国内地只有7家实验室通过了CAP认证,这反映出国内CRO的总体水平较低。缺乏符合国际检测水准的医学临床实验室,成为我国CRO发展的主要“瓶颈” 。一方面,由于创新药物的产品市场转化机制不健全,缺乏政策的有效支持,本土CRO企业很难将研发成果的积累转化为自主创新的专利药;另一方面,发达国家跨国制药企业向我国转移研发环节的步伐明显加快的同时,不断强化知识产权保护和战略资源的争夺。跨国制药巨头在华通过合资、并购等合法的资本运作手段,攫取本土CRO的科研成果。这将影响我国专利药物的自主创新进程,长此以往将导致我国制药企业被锁定在全球产业链的低端。
6.与国外医药企业在接包市场上的竞争加剧
目前,我国承接医药外包面临着众多竞争对手,其中主要竞争对手来自印度。印度仍是全球排名第一的医药外包基地,不论从接包规模还是外包项目的管理经验来看,其优势地位短时间很难撼动。捷克、俄罗斯、匈牙利等国家和地区也具有一定的产业基础,人才储备和研发能力等方面也各有特色。在国内市场上,跨国制药巨头在华的投资企业和分支机构凭借先进的经营和管理理念、规范的操作体制、及时跟进的新药研发信息,也对我国相关企业和机构形成强有力的竞争,而由于生产能力普遍过剩,国内制药企业之间的无序竞争一定程度上损害了我国在全球外包市场的声誉。
7.相关政策法规有待完善
在医药产业价值链分解不断深化、生产研发全球化的条件下,大力发展医药外包,承接医药业大跨国公司的产业转移和研发项目,成为我国优化医药业内部结构、提升行业综合素质的重要途径。为此,商务部等八部委联合发布了《关于促进医药产品出口的若干意见》 ,提出了到2010年力争医药产品年出口额达到230亿美元、到2020年医药产品年出口额达到1000亿美元的发展目标。尽管我国相关部门相继出台了一些鼓励医药企业和科研机构发展外包的政策措施,但由于外包对我国医药产业毕竟还是新事物,相关政策法规尚不完善,特别是由于知识产权保护力度不够,跨国公司向我国外包医药生产和研发仍有顾虑。另外,我国政府和相关部门对承接医药外包的风险重视不够。对于国外一些企业和机构以科研活动或临床测试外包的名义,大肆搜集我国病历资源及其相关的遗传生物信息,缺乏有效的监管和惩戒措施,导致我国珍贵的生命科学资源大量流失,给国家造成了不可挽回的损失。
专栏4-2
我国开展医药外包的优势与差距
承接医药外包不仅有利于我国充分利用医药化工生产能力,而且还将促进我国改善医药研发的管理体制,获得更多的学习机会,提高医药业的国际竞争力。目前,我国承接医药外包具备了一定的优势,但也存在不少问题和差距。
1.优势。
(1 )产品与规模优势。从产品品种和制造能力来说,经过长期发展,我国已经形成较完整的医药化工产业体系,成为医药产品的生产和出口大国。特别是在原料药领域,一些应用范围广、产品链长、技术成熟、大批量生产的原料药拥有突出的优势,有机酸类、氨基酸类、维生素类、抗生素类和解热镇痛类五大类化学原料药出口量占原料药出口总量的比重超过70%,这些原料药获得了大量的外包订单。制剂生产承接外包也有很大潜力,其中中低档产品已经具备了一定的国际竞争力。
(2 )制造技术和生产工艺优势。通过自主创新和引进消化吸收,我国化学原料药和部分制剂生产进入了成熟期,技术工艺水平明显提高。目前,我国有60多种原料药具有生产技术优势,微生物发酵类、半合成类药物的生产技术已达到国际领先水平。
(3 )成本优势。除了充足低廉的劳动力之外,我国部分原材料以及生产设备的价格也有优势,加之大量生产能力闲置进一步压低了我国接单外包的要价,使得我国原料药和制剂加工的总体成本远远低于发达国家的水平,仅为美国的1/10左右。在医药研发领域,我国不仅能以不足美国1/8的年薪提供医药化工、生物技术、机械工程等高质量的技术人员,而且在我国进行病源采集、药理分析、临床测试等研发活动的费用也比较低。
(4 )疾病谱资源优势。中国是地域辽阔、人口众多、历史悠久的多民族国家,疾病谱的资源十分丰富,为基因采集、药理分析、临床测试提供了有利的条件。在中国发展CRO,不仅可以节省研发经费,也可以充分利用自然资源、地方病、伦理关系等条件。
(5 )人才优势。近年来,随着高校扩招和国内人才管理体制改革的深化,我国人才供应数量和质量不断增长和提高,化学、生命科学等基础研究领域的人才储备已颇具规模。另外,改革开放以来,我国向海外输送了大量留学人员,据统计,目前约有超过2万华人在海外从事制药领域的研究。这些人才是很有开发和利用潜在价值的智力资源,将为我国企业与国外制药公司之间建立长期合作关系、提高国内CRO专业能力发挥一定的桥梁和纽带作用。
(6 )商业与政策环境的优势。改革开放三十多年来,中国经济保持了持续稳定的增长,对外开放和市场化进程不断加快,国际地位和影响力显著提高。利用外资的丰富经验为我国承接医药外包打下了良好的基础。近年来,我国政府对环境和知识产权的保护力度加大,药品监管体系不断完善,一系列新的法律法规逐步与国际接轨,科技创新的价值得以充分体现,产品、技术和服务市场日益繁荣,尤其是中国生物医药领域的进步,受到国际大制药公司越来越多的关注,使其纷纷在中国寻找外包项目合作伙伴。
2.劣势。
(1 )观念落后,信息掌握不充分,沟通渠道不畅。我国部分企业和科研机构由于观念落后,对国际医药外包市场的变化反应不敏感,相互之间缺乏协作,无法形成合力。如世界卫生组织每年要进行大量的药品政府采购,我国企业难以进入其竞标程序,而我国虽在基因克隆、抗体制备等多种领域具备了较强的研究能力,但这种能力分散在众多的研发机构中,单个科研机构很难拿到并独立完成医药大跨国公司的外包项目。
(2 )资本实力薄弱。我国承接医药外包要想加快由低附加值项目向高端领域的升级,企业和科研机构都需要大规模的投入,包括工艺设备更新、国际认证、人才培养与引进、风险管理等方面资金支持,而我国的科研机构和一些中小型的创新企业融资渠道匮乏,实现规模扩张的难度较大。
(3 )成本呈上升趋势。近年来,我国土地、能源、劳动力的价格不断攀升,部分产业政策收紧,环保要求提高,造成企业运营成本上升,特别是东部沿海城市的商务成本优势逐渐弱化,跨国公司对这些变化非常敏感,对向中国外包业务的决策更加慎重。
(4 )体制制约。尽管我国在商业环境、基础设施及经济增长稳定性等方面占优,但在外包经验、国际认证、服务质量、管理制度、企业信誉、政治体制、法律体系、英语水平、文化兼容性等方面仍与发包方的要求以及印度等主要竞争对手的水平存在一定的差距。
资料来源:作者整理。
五、结论与对策
顺应经济全球化的浪潮,医药外包应运而生,并迅速发展为世界制药业的主流商业模式。总体来看,外包符合医药产业升级和价值链全球优化配置的发展趋势,是医药业国际分工深化和商业模式创新的共同结果。首先,经济全球化的深化为医药业价值链的深度分解及其全球优化配置创造了条件,制药业大跨国公司把新药研制、临床测试、原料药和制剂生产、销售服务等各个业务环节外包给不同国家和地区的专业公司,从而缩短产品上市周期,降低成本。其次,世界范围内R&D国际化趋势增强导致药品研发日趋分散化。现代生物技术日新月异的发展使新药开发演变为极其复杂的系统工程,单一企业越来越难以具备独立开发新药的技术能力,承担全部的费用和风险,而必须依靠多家公司的合作,尤其需要一些拥有很强创新实力的中小企业和研发机构的协作参与。再次,在价值链深度分解的条件下,外包网络的构建与管理成为大制药企业核心能力的主要组成部分。通过控制价值链分解过程和药品专利,大制药公司仍然占据着医药价值链增值幅度最大的关键环节,而且在与研发、生产、营销等环节的专业外包商建立合同或战略合作关系的过程中,大制药公司不断拓展企业的资源边界,使其在全球资源配置中的主导地位进一步凸显。同时,日益复杂的外包网络对大制药企业的管理能力提出了更高的要求。对于现代医药业这类资本和知识密集度高的行业来说,面对技术快速更新和组织变革的不确定性,价值链上越来越多环节的外包也给领导型企业带来了新的风险,增加了管理成本。
从世界范围来看,医药产业生产转移和研发外包的总体趋势不断增强。同时,发达国家对新药审批和药效检测要求越来越严格,这为我国承接医药研发外包提供了更多的机会。目前,我国医药外包的平台逐步形成,中外医药企业和研究机构交流、磋商和合作的渠道增多。通过不断提高GMP软硬件规范,学习借鉴印度和东欧企业的经验,接受欧美国家一系列药政检验,我国承接原料药和制剂生产外包的规模迅速扩大,逐步成为全球主要的原料药和制剂外包目的国。然而,我国医药业发展同样存在大而不强的问题,研发能力、技术装备、管理模式与国际先进水平仍有差距。面对持续扩张的世界医药外包市场,应抓住机遇,大力发展医药业的外包,加快医药业生产研发模式创新,积极承接医药业国际产业转移,拓宽参与行业国际分工的渠道,提升我国制药和生物技术行业的国际竞争力。为此,应采取以下措施:
1.制定医药外包发展战略,促进医药业外包资源整合
加强对全球医药外包发展趋势的研究,制定我国承接医药外包的发展战略,成立专门的管理机构,广泛开展国际合作,加强与世界卫生组织等国际机构的沟通与协调,积极向国际大药品商推介我国有实力的外包企业。鼓励国内企业及科研机构加强与发达国家的生物医药企业合作,成立中外合资的CRO公司,学习国外先进的经营和管理经验,掌握国际新药研发的信息和动向,按国际标准来组织、管理外包业务。同时,充分发挥行业协会的作用,加强企业与科研机构的资源整合,积极推进产学研一体化,搭建医药外包的合作平台,成立外包服务中心,促使医药企业和科研机构之间形成合力,逐步融入全球外包服务市场,打造涵盖医药业生产研发各个环节的外包服务链,发掘医药业新的增长点,带动医药外包的升级发展。
2.建立完善相关法律法规,加强医药外包的监管
一方面,完善知识产权保护体系,对医药企业和研发机构承接外包给予积极的鼓励与扶持,加强政策之间的衔接与协调,为医药外包发展创造良好的政策环境;另一方面,加强临床基地的建设和管理,建立完善的临床试验与药品检验管理体制,制定有关医药外包特别是针对跨国公司及其他医疗和研究机构在华开展临床测试、药理分析以及病历收集的专项法规,对医药外包活动进行有效监管,维护参与测试人员的合法权益,有效保护我国基因、疾病谱及生命科学的相关资源。
3.加快技术改造与创新,全面提高外包企业的管理水平
在努力降低成本、保持既有优势的基础上,加强技术更新改造,鼓励医药企业积极开展各项国际认证工作。围绕着国际认证及相关标准实施,提高企业的质量管理水平和开拓市场的能力,加快企业和科研机构的信息化、知识化建设,形成国际化、高效、诚信的团队文化,培育我国具有国际竞争力的医药外包供应商、研发机构和CRO公司。
4.大力培养医药外包人才,提高外包人员的综合素质
发展医药外包,人才是关键。医药外包对相关人员的专业技能、外语、商务知识、团队精神等综合能力要求较高。目前,我国缺乏从事医药外包的专门人才,医药研发和生产合同管理项目经理的需求缺口更大。今后,应以高校教育为基础,积极引进医药外包的高级人才,结合企业培训和各种专项培训,加强外语及外包业务流程管理能力的培养,形成人才梯队,为企业开展外包业务提供充足的人才储备。
5.增强环保意识,促进医药外包可持续发展
从全球医药产业的发展趋势来看,各国对药品生产流程的环保要求越来越严格,环保理念已成为医药企业实现可持续发展的共识。欧美发达国家在制药行业中开始推行健康、安全和环保管理体系,即HSE管理体系,并普遍开展了ISO14000认证,而随着欧盟REACH法规的制定实施,欧盟化学原料药和制剂生产销售的环境标准大大提高。长期以来,我国制药企业环保意识比较淡薄,ISO14000认证工作相对滞后。随着产业发展国际环境的变化以及国家法律法规的进一步规范,国内医药企业承接外包的环境成本势必上升,企业生产运营的环保要求不断提高。在这种情况下,医药企业应协调好发展与环境保护之间的关系,以接单外包为契机,树立GMP理念,淘汰落后设备和产能,转变增长方式,积极开展ISO14000认证,提高产品环境标准,实现可持续发展。
参考文献:
[1]江小涓主编: 《服务全球化与服务外包:现状、趋势及理论分析》 ,人民出版社,2008年。
[2]郑柏勤: 《制药企业新药研发工作的组织管理》 , 《中国新药杂志》 ,2003年第10期。
[3]佟石、司春林: 《我国医药企业R&D管理组织创新模式研究》 , 《研究与发展管理》 ,2003年第6期。
[4]顾丽萍、杨潇潇: 《我国化学原料药的出口前景与对策》 , 《上海医药》 ,2004年第1期。
[5]杨丹辉: 《R&D国际化与跨国公司全球R&D项目的管理》 , 《经济管理·新管理》 ,2004年第8期。
[6]吴曙霞: 《我国原料药企业发展策略探讨》 , 《精细与专用化学品》 ,2004年第10期。
[7]郝婧、龚健: 《我国医药企业跨组织合作R&D外包的合作博弈分析》 , 《河北经贸大学学报》 ,2005年第2期。
[8]池仁勇、邵小芬、吴宝: 《全球价值链治理、驱动力和创新理论探析》 , 《外国经济与管理》 ,2006年第3期。
[9]干荣福: 《医药外包推动我国医药经济的新一轮发展》 , 《中国医药工业杂志》 ,2006年第2期。
[10]陈利君: 《印度医药产业崛起的原因与启示》 , 《云南社会科学》 ,2006年第5期。
[11]王少礼: 《印度医药产业发展经验可资借鉴》 , 《药业纵横》 ,2006年第5期。
[12]邱家学、袁方: 《药品研发外包模式探讨》 , 《上海医药》 ,2006年第8期。
[13]秦仪: 《关于服务外包的价值链研究》 , 《国际商务》 ,2007年第4期。
[14]陈菲琼、王丹霞: 《全球价值链的动态性与企业升级》 , 《科研管理》 ,2007年第5期。
[15]贺蕾: 《全球生物医药产业价值链的动态变化及其政策含义》 , 《湖南社会科学》 ,2007年第6期。
[16]李军、杨学儒: 《全球价值链形态与国际竞争力》 , 《经济研究导刊》 ,2008年第4期。
[17]黄庆波、史云霞: 《跨国公司研发外包趋势与中国企业的选择》 , 《经济导刊》 ,2008年第5期。
[18]曹崴: 《基于系统集成理论的中国医药外包产业分析》 , 《现代管理科学》 ,2009年第5期。
[19]王蔚佳: 《接单外包:中国制药企业开始进入全球医药产业链》 , 《中国医药报》 ,2005年第12期。
[20]吕宙翔: 《世界医药外包的发展趋势及中国面临的机遇与挑战》 , 《世经评论》 ,2006年第1期。
[21]张晶: 《新药探险:医药外包公司缘何在中国大行其道? 》 , 《第一财经周刊》 ,2009年第5期。
[22]王静波: 《全球合同研发外包年第CRO期服务业发展动态与趋势》 ,http://www. istis.sh.cn/list/list.asp?id=801。
[23]杨丹辉: 《医药业外包的发展与我国的对策》 , 《中国工业经济研究所研究报告》 ,2007年8月。
[24] Arns,M.,Fischer M. Kemper P. and Tepper C. (2002 ): “Supply Chain Modelling and Its Analytical Evaluation” ,Journal of the Operational Research Society,53(8 ) ,885-894.
[25] Cardinal,Laura B. ( 2001 ): “Technological Innovation in the Pharmaceutical Industry:The Use of Organizational Control in Managing Research and Development”, Organization Science,12(1 ) ,19-36.
[26] Carleysmith,Stephen W.,Ann M. Dufton and Kevin D. Altria ( 2009 ): “Implementing Lean Sigma in Pharmaceutical Research and Development:a Review by Practitioners” ,R&D Management,39(1 ) ,95-106.
[27] Chittoor,Raveendra and Sougata Ray (2007 ): “Internationalization Paths of Indian Pharmaceutical Firms-A Strategic Group Analysis” ,Journal of International Management,13 (3 ) ,338-355.
[28] Coombs,R. and Metcalfe,J. S. ( 2002 ): “Innovation in Pharmaceuticals:Perspective on Coordination,Combination and Creation of Capability” ,Technology Analysis and Strategic Management,14(3 ) ,261-271.
[29] Doh,J.P. ( 2005 ): “Offshore Outsourcing:Implications for International Business and Strategic Management Theory and Practice” ,Journal of Management Studies,43(2 ) ,695-704.
[30] Gereffi,G (1999 ): “International Trade and Industrial Upgrading in the Apparel Commodity Chain” ,Journal of International Economics,48 ( 1999 ),37-70.
[31] Gereffi,G.,Humphrey,J. and Sturgeon,T. (2003 ): “The Governance of Global Value Chains” ,Review of International Political Economy,11(4 ) ,5-11.
[32] Griffith,R.,Rupert Harrison and John Van Reenen (2006 ): “How Special is the Special Relationship? Using the Impact of US R&D Spillovers on UK Firms as a Test of Technology Sourcing” ,The American Economic,Review,96(5 ) ,1859-1875.
[33] Hame,G.,and C.K. Prahalad ( 1990 ): “The Core Competence of the Corporation” ,
Harvard Business Review,68(3 ) ,May-June,79-93.
[34] Howells,J.,D. Gagliardi and K. Malik (2008 ): “The Growth and Management of R&D Outsourcing:Evidence from UK Pharmaceuticals” ,R&D Management,38(2 ) ,205-219.
[35] Hui,Pamsy P.,Alison David-Blake and Joseph P. Broschak (2008 ): “Managing Interdependence:The Effect of Outsourcing Structure on the Performances of Complex Projects” ,Decision Science,3(1 ) ,5-31.
[36] Jones,Oswald (2000 ): “Innovation Management as a Post-Modern Phenomenon:The Outsourcing of Pharmaceutical R&D” ,British Journal of Management,11(4 ) ,341-356.
[37] Lai,Edwin L.-C.,R. Riezman and Ping Wang ( 2003 ): “Outsourcing of Innovation” ,Working Paper,City University of Hong Kong.
[38] Lewi,Paul J. and Adam Smith ( 2007 ): “Successful Pharmaceutical Discovery:Paul Janssen’ s Concept of Drug Research” ,R&D Management,37(4 ) ,355 - 362.
[39] Levy,D. (1995 ): “International Sourcing and Supply Chain Stability” ,Journal of International Business Studies,26(2 ) ,343-360.
[40] Lim,P. L. L.,E. Garnsey and M. Gregory ( 2006 ): “Product and Process Innovation in Biopharmaceuticals:a New Perspective on Development” ,R&D Management,36(1 ) ,27-36.
[41] Love. J. H. and S. Roper ( 2001 ): “Outsourcing in the Innovation Process:Locational an Strategic Determinants” ,Regional Science,80 ( April ),317-336.
[42] Kotabe Masaaki,Denise Dunlap-Hinkler,Ronaldo Parente and Harsh A. Mishra ( 2007 ): “Determinants of Cross-National Knowledge Transfer and Its Effect on Firm Innovation” ,Journal of International Business Studies,38(2 ) ,259-282.
[43] Marjit,S. and A. Mukherjee (2008 ): “International Outsourcing and R&D:Long-run Implications for Consumers” ,Review of International Economics,16(5 ) ,1010-1022.
[44] Novak,S. and S. D. Epinger ( 2001 ): “Sourcing by Design:Product Complexity and the Supply Chain” ,Design and Development,47(1 ) ,189-204.
[45] Parker,David W. and Katee A. Russell ( 2004 ): “Outsourcing and Inter/intra Supply Chain Dynamics:Strategic Management Issues” ,The Journal of Supply Chain Management:A Global Review of Purchasing and Supply,November,56-67.
[46] Sanna-Randaccio,F. and Reinhilde Veugelers (2007 ): “Multinational Knowledge Spillovers with Decentralised R&D: A Game -Theoretic Ap proach” , Journal of International Business Studies,38(1 ) ,47-63.
[47] Schmid E.F. and Smith D.A ( 2004 ): “Is Pharmaceutical R&D Just a Game of Chance or Can Strategy Make a Difference? ” ,Drug Discovery Today,9(1 ) ,18-26.
[48] Tapon ,A ( 1989 ): “Transaction Costs Analysis of Innovations in the Organization of Pharmaceutical R&D” ,Journal of Economic Behavior & Organization,14(2 ) ,21-28.
[49] Ulset,S. (1996 ): “R&D Outsourcing and Contractual Governance:An Empirical Study of Commercial R&D Projects” , Journal of Economic Behavior and Organization, 30 ( 1996 ),63-82.
[50] United Nations Industrial Organization (2002 ): “Competing through Innovation and Learning-the Focus of UNIDO’ s Industrial Development 2002/2003” ,Vienna,107-116.
[51] Varlan,E. and R Le Paillier (1999 ): “Multicriteria Decision Making for Contract Research Organisation Choice in the Pharmaceutical Industry”, The Journal of Operational Research Society,50(9 ) ,943-948.
[52] Vareska van de Vrande, Charmianne Lemmens, Wim Vanhaverbeke(2006 ):“Choosing Governance Modes for External technology Sourcing” ,R&D Management,36(3 ) ,347-363.
[53] Williams,Christopher and Soo Hee Lee ( 2009 ): “Exploring the Internal and External Venturing of Large R&D-intensive Firms” ,R&D Management,36(3 ) ,231-246.
[54] Williamson, Oliver E. (2008 ): “Outsourcing: Transaction Cost Economics and Supply Chain Management” ,The Journal of Supply Chain Management,April,5-16.
[55] Yeoh, Poh -lin and kendoll Roth (1999 ): “An Empirical Analysis of Sustained Advantage in the U. S. Pharmaceutical Industry:Impact of Firm Resources and Capabilities” ,Strategic Management Journal,20(7 ) ,637-653.
【注释】
[1]“制药界外包业务将带来国际产业链的重塑” ,新华社,2006年1月9日。
[2]Ernst,D. (2002 ) : “Global Production Networks and the Changing Geography of Innovations Systems” ,Economics of Innovation and New Technology,11(6 ) ,501-502.
[3]Howells、Gagliardi和Malik ( 2008 )对英国医药企业研发外包的一项实证分析验证了被外包出去的研发业务主要是应用性或非核心的环节。
[4]陈菲琼、王丹霞: “全球价值链的动态性与企业升级” , 《科研管理》 ,2007年第5期,第53页。
[5]吕宙翔: “世界医药外包的发展趋势及中国面临的机遇与挑战” , 《世经评论》 ,2006年1月13日。
[6]江小涓主编: 《服务全球化与服务外包:现状、趋势及理论分析》 ,人民出版社,2008年,第125页。
[7]赵新远: 《2012年CRO市场将超过262亿美元》 ,http://chinasourcing.mofcom.gov.cn/content2.jsp?id=31162。
[8]“医药外包趋势向好、药企应找准定位力克风险” ,国研网,2007年7月20日。
有关全球化:服务外包与中国的政策选择的文章

第十章软件和信息服务外包:发展现状与中国创新能力的提升软件和信息服务外包是全球服务外包市场的主要组成部分。我国在软件和信息服务外包方面有自己的优势,发展软件和信息服务外包符合我国产业升级的要求。作为服务外包的核心,软件与信息服务外包较充分地体现了服务外包人力资本市场合约与劳务市场合约统一的特点。表10-1软件与信息服务外包分类资料来源:作者整理。2.软件与信息服务外包的模式(1 )整体项目外包。......
2023-12-05

在2016年9月颁布的《中国学生发展核心素养》总体框架中就提出了“以培养‘全面发展的人’为核心”的理念。目前,大部分国家的关键能力框架,入选频率较高的能力指标主要聚焦在“4C”,即沟通、合作、创新、审辨思维。北京师范大学中国教育创新研究院发布《21世纪核心素养5C模型研究报告》,在“4C”基础上又增加了文化理解与传承,赋予关键能力培养以本土文化特色。......
2023-08-06

实训目的构建安全、健壮、高效的双核心网络,掌握交换机和路由器常用功能的配置,以及动态路由、冗余备份、负载均衡、多生成树的配置方法。实训设备RG-R1762路由器1台,RG-S3760交换机2台,RG-S2126交换机2台,PC 4台,直通网线若干。图6-2双核心网络拓扑图例实训步骤1.配置VRRP按图6-2连接各实训设备。S2126A:作为接入层,只需做一些基本的vlan配置即可。配置S2126 A的f 0/2为Trunk口S2126A#exitS2126A#interface range f 0/3-10!进入f 0/3—f 0/10接口S2126A#switchport access vlan 10!将这些接口划入VLAN 10中S2126A#exitS2126A#interface range f 0/11-15!......
2023-11-17

《普通高中数学课程标准2017年版》提出:通过高中数学课程的学习,学生能获得进一步学习以及未来发展所必须的数学基础知识、基本技能、基本思想、基本活动经验;提高从数学角度发现和提出问题的能力、分析和解决问题的能力.从关键能力角度考察数学运算素养,可以从运算的本质出发,考察数学运算对象,理解数学运算的应用,类比运算法则的运用等.【案例2-17】极限思想中的数学运算素养1.真题重现2.考点分析利用极限的......
2023-08-17

书中主人翁黛比是个凡事亲历亲为,主要时间忙于“救火”,忙于修补“漏洞”的人。后来,黛比经过培训,转变了观念,最终成为深受下属爱戴、信任,自愿服务于员工的优秀管理者。这才是员工发挥核心能力的最佳条件。......
2024-02-23

逻辑推理素养作为高中数学学科核心素养之一,从培养和发展学生关键能力的角度出发,也是其考查标准的重要维度之一.【案例3-20】数形结合问题:若实系数一元二次方程x2+ax+2b=0有两个根,一个根在区间(0,1)内,另一个根在区间(1,2)内,求:(1)点(a,b)对应的区域的面积;(2)的取值范围;(3)(a-1)2+(b-2)2的值域.解 可将看作点(a,b)和(1,2)连线的斜率,(a-1)2......
2023-08-17

探究7:若将焦点F改为点F2,对应准线改为直线=1,则圆、椭圆是否具有组合1、2、3的性质?事实上,点F2是直线l的极点,直线l是点F2的极线.给定圆或圆锥曲线Γ,当极点在Γ内时,其对应的极线与Γ相离;当极点在Γ上时,其对应的极线与Γ相切;当极点在Γ外时,其对应的极线与Γ相交.由极点和对应的极线,可得一系列的调和点列.......
2023-08-17

提高学生“音乐学科核心素养”是音乐教学研究和教学实践的主要议题,音乐核心素养的培养过程是一个音乐基础知识不断积累、音乐能力逐渐增强、音乐情感得到升华的过程。2017年《普通高中音乐课程标准》出台,其中专门对音乐学科核心素养进行了明确的表述,将音乐学科的核心素养规定在审美感知、艺术表现和文化理解三方面。......
2023-08-12
相关推荐